| №п/п |
Назва лікарського засобу |
Форма випуску |
Заявник |
Країна |
Виробник |
Країна |
Реєстраційна процедура |
Умови відпуску |
Номер реєстраційного посвідчення |
| 1. |
L-ЛІЗИНУ ЕСЦИНАТ® |
розчин для ін’єкцій, 1 мг/мл по 5 мл в ампулі; по 5 ампул у блістері, покритому плівкою; по 2 блістери у пачці; in bulk: по 5 мл в ампулі; по 462 ампули в коробі картонному |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Контроль допоміжних речовин. Зміна параметрів специфікацій та/або допустимих меж для допоміжної речовини (інші зміни) Супутня зміна — Зміни з якості. Готовий лікарський засіб. Контроль допоміжних речовин. Зміна у методах випробування допоміжної речовини (інші зміни у методах випробування (включаючи заміну або додавання)) Приведення специфікацій та методів контролю на допоміжні речовини Вода для ін’єкцій та Пропіленгліколь до вимог монографій Євр.Фарм. Для допоміжної речовини Вода для ін’єкцій вилучення показника «рН» та редакційні уточнення для показника «Мікробіологічний моніторинг», для допоміжної речовини Пропіленгліколь редакційні уточнення для показників «Ідентифікація» та «Розчинність». |
За рецептом |
UA/2131/01/01 |
| 2. |
L-ЛІЗИНУ ЕСЦИНАТ® |
розчин для ін’єкцій, 1 мг/мл in bulk: по 5 мл в ампулі; по 462 ампули в коробі картонному |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Контроль допоміжних речовин. Зміна параметрів специфікацій та/або допустимих меж для допоміжної речовини (інші зміни) Супутня зміна — Зміни з якості. Готовий лікарський засіб. Контроль допоміжних речовин. Зміна у методах випробування допоміжної речовини (інші зміни у методах випробування (включаючи заміну або додавання)) Приведення специфікацій та методів контролю на допоміжні речовини Вода для ін’єкцій та Пропіленгліколь до вимог монографій Євр.Фарм. Для допоміжної речовини Вода для ін’єкцій вилучення показника «рН» та редакційні уточнення для показника «Мікробіологічний моніторинг», для допоміжної речовини Пропіленгліколь редакційні уточнення для показників «Ідентифікація» та «Розчинність». |
— |
UA/9507/01/01 |
| 3. |
АБИФЛОКС® |
таблетки, вкриті плівковою оболонкою, по 250 мг, по 10 таблеток у блістері, по 1 блістеру в упаковці |
Абрил Формулейшнз Пвт. Лтд. |
Індія |
Ауробіндо Фарма Лімітед — Юніт VII |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна назви та адреси виробничої дільниці ГЛЗ, без зміни місця виробництва |
За рецептом |
UA/14416/01/01 |
| 4. |
АБИФЛОКС® |
таблетки, вкриті плівковою оболонкою, по 500 мг, по 10 таблеток у блістері, по 1 блістеру в упаковці |
Абрил Формулейшнз Пвт. Лтд. |
Індія |
Ауробіндо Фарма Лімітед — Юніт VII |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна назви та адреси виробничої дільниці ГЛЗ, без зміни місця виробництва |
За рецептом |
UA/14416/01/02 |
| 5. |
АЛЛЕРТЕК® |
таблетки, вкриті оболонкою, по 10 мг, по 7 або по 20 таблеток у блістері; по 1 блістеру в картонній коробці |
Варшавський фармацевтичний завод Польфа АТ |
Польща |
Фармацевтичний завод «Польфарма» С.А. |
Польща |
внесення змін до реєстраційних матеріалів: приведення у відповідність до інструкції для медичного застосування написання умов відпуску в наказі МОЗ України № 1134 від 17.05.2019 в процесі внесення змін (
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи заявника, відповідальної за фармаконагляд : Діюча редакція : Dr. Izabella Slowik. Пропонована редакція : Krzysztof Karpinski). Редакція в наказі — за рецептом. Запропонована редакція — без рецепта. |
Без рецеп та |
UA/6422/02/01 |
| 6. |
АМІФЕНА ІС |
таблетки, вкриті плівковою оболонкою, по 250 мг по 10 таблеток у блістері, по 2 блістери у пачці |
Товариство з додатковою відповідальністю «ІНТЕРХІМ» |
Україна |
Товариство з додатковою відповідальністю «ІНТЕРХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна назви виробника АФІ Мефенамінова кислота, без зміни місця виробництва |
Без рецепта |
UA/16620/01/01 |
| 7. |
АМІФЕНА ІС |
таблетки, вкриті плівковою оболонкою, по 500 мг; по 10 таблеток у блістері, по 2 блістери у пачці |
Товариство з додатковою відповідальністю «ІНТЕРХІМ» |
Україна |
Товариство з додатковою відповідальністю «ІНТЕРХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна назви виробника АФІ Мефенамінова кислота, без зміни місця виробництва |
Без рецепта |
UA/16620/01/02 |
| 8. |
АРГЕТТ ДУО |
капсули з модифікованим вивільненням тверді по 75 мг по 10 капсул у блістері; по 1, або по 2, або по 3 блістери у картонній коробці |
Дельта Медікел Промоушнз АГ |
Швейцарія |
первинне та вторинне пакування, випуск серії:
Свісс Капс ГмбХ, Німеччина
виробництво нерозфасованої продукції, контроль якості:
Теммлер Ірландія Лімітед, Ірландiя
первинне та вторинне пакування:
Драгенофарм Апотекер Пюшл ГмбХ, Німеччина |
Німеччина/ Ірландія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи заявника, відповідальної за здійснення фармаконагляду: Діюча редакція: Терентьєв Олександр Юрійович. Пропонована редакція : Рогинська Олена Павлівна.
Зміна контактних даних уповноваженої особи заявника, відповідальної за здійснення фармаконагляду. |
За рецептом |
UA/12811/01/01 |
| 9. |
АСМАНЕКС® |
порошок для інгаляцій, дозований, 200 мкг/дозу; по 30 доз або по 60 доз в інгаляторі Твистхейлер®, упакованому в алюмінієву фольгу; по 1 упакованому інгалятору в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Контроль якості, вторинне пакування, випуск серії:Шерінг-Плау Лабо Н.В., Бельгія;Виробник in bulk, первинне пакування:МСД Інтернешнл ГмбХ (філія Сінгапур), Сiнгапур |
Бельгія/Сінгапур |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) Уточнення адреси заявника (власника реєстраційного посвідчення): |
Заа рецептом |
UA/9255/01/01 |
| 10. |
АСМАНЕКС® |
порошок для інгаляцій, дозований, 400 мкг/дозу; по 30 доз або по 60 доз в інгаляторі Твистхейлер®, упакованому в алюмінієву фольгу; по 1 упакованому інгалятору в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Контроль якості, вторинне пакування, випуск серії:Шерінг-Плау Лабо Н.В., Бельгія;Виробник in bulk, первинне пакування:МСД Інтернешнл ГмбХ (філія Сінгапур), Сiнгапур |
Бельгія/Сінгапур |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) Уточнення адреси заявника (власника реєстраційного посвідчення): |
Заа рецептом |
UA/9255/01/02 |
| 11. |
АСМАНЕКС® |
порошок для інгаляцій, дозований, 200 мкг/дозу по 30 доз або по 60 доз в інгаляторі Твистхейлер®, упакованому в алюмінієву фольгу; по 1 упакованому інгалятору в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Контроль якості, вторинне пакування, випуск серії:
Шерінг — Плау Лабо Н.В., Бельгія
Виробник in bulk, первинне пакування:
МСД Інтернешнл ГмбХ (філія Сінгапур), Сiнгапур |
Бельгія/Сiнгапур |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна місця здійснення основної діяльності з фармаконагляду.
Зміна місцезнаходження мастер-файла. |
За рецептом |
UA/9255/01/01 |
| 12. |
АСМАНЕКС® |
порошок для інгаляцій, дозований, 400 мкг/дозу по 30 доз або по 60 доз в інгаляторі Твистхейлер®, упакованому в алюмінієву фольгу; по 1 упакованому інгалятору в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Контроль якості, вторинне пакування, випуск серії:
Шерінг-Плау Лабо Н.В., Бельгія
Виробник in bulk, первинне пакування:
МСД Інтернешнл ГмбХ (філія Сінгапур), Сiнгапур |
Бельгія/Сiнгапур |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна місця здійснення основної діяльності з фармаконагляду.
Зміна місцезнаходження мастер-файла. |
За рецептом |
UA/9255/01/02 |
| 13. |
АСПІРИН КАРДІО® |
таблетки, вкриті кишковорозчинною оболонкою, по 300 мг, по 14 таблеток у блістері, по 2 блістери в картонній пачці |
Байєр Консьюмер Кер АГ |
Швейцарія |
Байєр АГ, Німеччина;
Байєр Біттерфельд ГмбХ, Німеччина |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна адреси виробника Байєр Біттерфельд ГмбХ, Німеччина, без зміни місця виробництва. Зміни внесені в інструкцію для медичного застосування щодо місцезнаходження виробника, як наслідок — відповідні зміни у текст маркування лікарського засобу |
Без рецепта |
UA/7802/01/02 |
| 14. |
АТОРВАСТАТИН-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 10 мг по 10 таблеток у блістері по 3 або 6, або 9 блістерів у коробці |
ТОВ «Тева Україна» |
Україна |
Тева Фарма С.Л.У. |
Іспанiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R0-CEP 2018-059-Rev 00 для діючої речовини Atorvastatin calcium trihydrate для нової виробничої дільниці від вже затвердженого виробника;
Зміни І типу — введення періоду повторного випробовування 36 місяців для нової виробничої дільниці АФІ TEVA PHARMACEUTICAL INDUSTRIES LTD.(СЕР № R0-CEP 2018-059-Rev 00);
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R1-CEP 2010-366-Rev 00 для діючої речовини Atorvastatin calcium trihydrate від нового виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2011-234-Rev 00 для діючої речовини від вже затвердженого виробника |
За рецептом |
UA/16377/01/01 |
| 15. |
АТОРВАСТАТИН-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 20 мг по 10 таблеток у блістері по 3 або 6, або 9 блістерів у коробці |
ТОВ «Тева Україна |
Україна |
Тева Фарма С.Л.У. |
Іспанiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R0-CEP 2018-059-Rev 00 для діючої речовини Atorvastatin calcium trihydrate для нової виробничої дільниці від вже затвердженого виробника;
Зміни І типу — введення періоду повторного випробовування 36 місяців для нової виробничої дільниці АФІ TEVA PHARMACEUTICAL INDUSTRIES LTD.(СЕР № R0-CEP 2018-059-Rev 00);
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R1-CEP 2010-366-Rev 00 для діючої речовини Atorvastatin calcium trihydrate від нового виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2011-234-Rev 00 для діючої речовини від вже затвердженого виробника |
За рецептом |
UA/16377/01/02 |
| 16. |
АТОРВАСТАТИН-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 40 мг по 10 таблеток у блістері по 3 або 9 блістерів у коробці |
ТОВ «Тева Україна» |
Україна |
Тева Фарма С.Л.У. |
Іспанiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R0-CEP 2018-059-Rev 00 для діючої речовини Atorvastatin calcium trihydrate для нової виробничої дільниці від вже затвердженого виробника;
Зміни І типу — введення періоду повторного випробовування 36 місяців для нової виробничої дільниці АФІ TEVA PHARMACEUTICAL INDUSTRIES LTD.(СЕР № R0-CEP 2018-059-Rev 00);
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R1-CEP 2010-366-Rev 00 для діючої речовини Atorvastatin calcium trihydrate від нового виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2011-234-Rev 00 для діючої речовини від вже затвердженого виробника |
За рецептом |
UA/16377/01/03 |
| 17. |
АТОРВАСТАТИН-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 80 мг по 10 таблеток у блістері по 3 або 9 блістерів у коробці |
ТОВ «Тева Україна» |
Україна |
Тева Фарма С.Л.У. |
Іспанiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R0-CEP 2018-059-Rev 00 для діючої речовини Atorvastatin calcium trihydrate для нової виробничої дільниці від вже затвердженого виробника;
Зміни І типу — введення періоду повторного випробовування 36 місяців для нової виробничої дільниці АФІ TEVA PHARMACEUTICAL INDUSTRIES LTD.(СЕР № R0-CEP 2018-059-Rev 00);
Зміни І типу — подання нового сертифіката відповідності Європейській фармакопеї № R1-CEP 2010-366-Rev 00 для діючої речовини Atorvastatin calcium trihydrate від нового виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2011-234-Rev 00 для діючої речовини від вже затвердженого виробника |
За рецептом |
UA/16377/01/04 |
| 18. |
АТРОГРЕЛ |
таблетки, вкриті плівковою оболонкою, по 75 мг по 10 таблеток у блістері; по 1, 3 або 6 блістерів у пачці з картону |
Публічне акціонерне товариство «Науково-виробничий центр «Борщагівський хіміко-фармацевтичний завод» |
Україна |
Публічне акціонерне товариство «Науково-виробничий центр «Борщагівський хіміко-фармацевтичний завод» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу (вилучення несуттєвого випробування в процесі виробництва);
Зміни І типу — незначні зміни в методах випробування готового лікарського засобу т. «Супровідні домішки» — додатково введено формули розрахунку вмісту домішок |
За рецептом |
UA/6567/01/01 |
| 19. |
АТТЕНТО® 20/5 |
таблетки, вкриті плівковою оболонкою, по 20 мг/ 5 мг; по 14 таблеток у блістері; по 1 або 2 блістери в картонній коробці з маркуванням українською мовою |
Менаріні Інтернешонал Оперейшонс Люксембург С.А. |
Люксембург |
виробництво in bulk, пакування, контроль та випуск серій: Даічі Санкіо Юроуп ГмбХ, Німеччина; пакування, контроль та випуск серій: БЕРЛІН-ХЕМІ АГ, Нiмеччина |
Нiмеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. |
За рецептом |
UA/13780/01/01 |
| 20. |
АТТЕНТО® 40/10 |
таблетки, вкриті плівковою оболонкою, по 40 мг/ 10 мг; по 14 таблеток у блістері; по 1 або 2 блістери в картонній коробці з маркуванням українською мовою |
Менаріні Інтернешонал Оперейшонс Люксембург С.А. |
Люксембург |
виробництво in bulk, пакування, контроль та випуск серій: Даічі Санкіо Юроуп ГмбХ, Німеччина; пакування, контроль та випуск серій: БЕРЛІН-ХЕМІ АГ, Нiмеччина |
Нiмеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. |
За рецептом |
UA/13780/01/02 |
| 21. |
АТТЕНТО® 40/5 |
таблетки, вкриті плівковою оболонкою, по 40 мг/ 5 мг; по 14 таблеток у блістері; по 1 або 2 блістери в картонній коробці з маркуванням українською мовою |
Менаріні Інтернешонал Оперейшонс Люксембург С.А. |
Люксембург |
виробництво in bulk, пакування, контроль та випуск серій: Даічі Санкіо Юроуп ГмбХ, Німеччина; пакування, контроль та випуск серій: БЕРЛІН-ХЕМІ АГ, Нiмеччина |
Нiмеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. |
За рецептом |
UA/13781/01/01 |
| 22. |
АЦИКЛОВІРУ НАТРІЄВА СІЛЬ СТЕРИЛЬНА |
порошок (субстанція) у бідонах алюмінієвих для фармацевтичного застосування |
ПАТ «Київмедпрепарат» |
Україна |
ПАТ «Київмедпрепарат» |
Україна |
внесення змін до реєстраційних матеріалів:Зміни II типу — Зміни з якості. АФІ. Контроль АФІ. Зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ (вилучення параметра специфікації, який може мати суттєвий влив на якість АФІ та/або готового лікарського засобу) вилучення зі специфікації АФІ показника «Аномальна токсичність», з відповідним методом контролю |
— |
UA/10020/01/01 |
| 23. |
БІНОКРИТ® |
розчин для ін’єкцій, 84 мкг/мл; по 0,8 мл (8000 МО) або 1 мл (10 000 МО) розчину для ін’єкцій в попередньо заповненому, градуйованому шприці, оснащеному поршнем, ін’єкційною голкою, ковпачком та захисним пристроєм для запобігання пошкодженню голкою після застосування, або без нього; по 1 шприцу у контурній блістерній упаковці; по 1 контурній блістерній упаковці у картонній коробці; по 0,4 мл (4000 МО), або 0,6 мл (6000 МО), або по 0,8 мл (8000 МО), або 1 мл (10 000 МО) розчину для ін’єкцій, в попередньо заповненому, градуйованому шприці, оснащеному поршнем, ін’єкційною голкою, ковпачком та захисним пристроєм для запобігання пошкодженню голкою після застосування, або без нього; по 3 шприца у контурній блістерній упаковці; по 2 контурні блістерні упаковки в картонній коробці |
Сандоз ГмбХ |
Австрія |
відповідальний за виробництво, пакування, контроль серії:
Ай Ді Ті Біологіка ГмбХ, Німеччина
відповідальний за випуск серії:
Сандоз ГмбХ — БП Шафтенау, Австрія |
Німеччина/ Австрія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна розміру серії (включаючи діапазони) АФІ або проміжного продукту, який застосовується у процесі виробництва АФІ — зміна розміру серії АФІ;
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — зміна у методах випробування АФІ за показником «Host cell protein»;
Зміни І типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ — вилучення зі специфікації АФІ показника «rDNA» |
За рецептом |
UA/12383/01/01 |
| 24. |
БІНОКРИТ® |
розчин для ін’єкцій, 16,8 мкг/мл; по 0,5 мл (1000 МО) або по 1 мл (2000 МО) розчину для ін’єкцій в попередньо заповненому, градуйованому шприці, оснащеному поршнем, ін’єкційною голкою, ковпачком та захисним пристроєм для запобігання пошкодженню голкою після застосування, або без нього; по 3 шприца у контурній блістерній упаковці; по 2 контурні блістерні упаковки у картонній коробці |
Сандоз ГмбХ |
Австрія |
відповідальний за виробництво, пакування, контроль серії:
Ай Ді Ті Біологіка ГмбХ, Німеччина
відповідальний за випуск серії:
Сандоз ГмбХ — БП Шафтенау, Австрія |
Німеччина/ Австрія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна розміру серії (включаючи діапазони) АФІ або проміжного продукту, який застосовується у процесі виробництва АФІ — зміна розміру серії АФІ;
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — зміна у методах випробування АФІ за показником «Host cell protein»;
Зміни І типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ — вилучення зі специфікації АФІ показника «rDNA» |
За рецептом |
UA/12383/01/02 |
| 25. |
БІНОКРИТ® |
розчин для ін’єкцій, 336 мкг/мл; по 0,5 мл (20 000 МО) або по 0,75 мл (30 000 МО), або по 1 мл (40 000 МО) розчину для ін’єкцій в попередньо заповненому, градуйованому шприці, оснащеному поршнем, ін’єкційною голкою, ковпачком та захисним пристроєм для запобігання пошкодженню голкою після застосування, або без нього; по 1 або по 3 попередньо заповнених шприца у контурній блістерній упаковці; по 1 (1 шприц у кожній) або по 2 (3 шприца у кожній) контурні блістерні упаковки в картонній коробці |
Сандоз ГмбХ |
Австрія |
відповідальний за виробництво, пакування, контроль серії:
Ай Ді Ті Біологіка ГмбХ, Німеччина
відповідальний за випуск серії:
Сандоз ГмбХ — БП Шафтенау, Австрія |
Німеччина/ Австрія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна розміру серії (включаючи діапазони) АФІ або проміжного продукту, який застосовується у процесі виробництва АФІ — зміна розміру серії АФІ;
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — зміна у методах випробування АФІ за показником «Host cell protein»;
Зміни І типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ — вилучення зі специфікації АФІ показника «rDNA» |
За рецептом |
UA/12383/01/03 |
| 26. |
БУСТРИКС![™]() ПОЛІО КОМБІНОВАНА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ) ТА ПОЛІОМІЄЛІТУ (ІНАКТИВОВАНА) (АДСОРБОВАНА, ЗІ ЗМЕНШЕНИМ ВМІСТОМ АНТИГЕНІВ) ПОЛІО КОМБІНОВАНА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ) ТА ПОЛІОМІЄЛІТУ (ІНАКТИВОВАНА) (АДСОРБОВАНА, ЗІ ЗМЕНШЕНИМ ВМІСТОМ АНТИГЕНІВ) |
суспензія для ін’єкцій по 1 дозі (0,5 мл/дозу) по 1 дозі у попередньо наповненому шприці; по 1 попередньо наповненому шприцу у комплекті з двома голками в пластиковому контейнері; по 1 контейнеру у картонній коробці |
ГлаксоСмітКляйн Експорт Лімітед |
Велика Британiя |
ГлаксоСмітКляйн Біолоджікалз С.А. |
Бельгiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — узгодження матеріалів реєстраційного досьє з виробничою практикою щодо документації, яка використовується при контролі якості при виробництві проміжного продукту інактивованого моновалентного поліовірусу (IPV). Внесення редакційних правок до розділу 3.2.S.2.4 |
За рецептом |
UA/15071/01/01 |
| 27. |
ВАЛЕРІАНИ ЕКСТРАКТ ГУСТИЙ |
екстракт густий (субстанція) в бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції |
— |
UA/6809/01/01 |
| 28. |
ВЕРОРАБ/VERORAB ВАКЦИНА АНТИРАБІЧНА ІНАКТИВОВАНА СУХА |
порошок для суспензії для ін’єкцій по 1 флакону з порошком (1 доза) та 1 попередньо заповненому шприцу (0,5 мл), що містить розчинник (0,4% розчин натрію хлориду), в картонній упаковці; по 5 флаконів з порошком (1 доза) у комплекті з розчинником (0,4% розчин натрію хлориду) в ампулах по 0,5 мл №5 в картонній упаковці |
Санофі Пастер С.А. |
Францiя |
повний цикл виробництва, контроль якості, вторинне пакування, випуск серії: Санофі Пастер, Францiя; повний цикл виробництва, контроль якості розчинника в ампулах: ГАУПТ ФАРМА ЛІВРОН, Францiя; повний цикл виробництва, контроль якості розчинника в шприцах: САНОФІ ВІНТРОП ІНДАСТРІА, Францiя; вторинне пакування: Санофі-Авентіс Прайвіт Ко. Лтд, Угорщина |
Францiя/Угорщина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни в процесі виробництва АФІ — зміна розчину, що використовується для санітарної обробки/зберігання ультрафільтраційної мембрани;
Зміни І типу — зміна періоду повторних випробувань/періоду зберігання або умов зберігання АФІ — зменшення терміну придатності діючої речовини та нові терміни придатності для проміжних продуктів діючої речовини для узгодження з виробничою практикою; зміни II типу — зміна у безпосередній упаковці АФІ — зміна первинної упаковки для діючої речовини та проміжних продуктів діючої речовини |
За рецептом |
UA/13038/01/01 |
| 29. |
ВОДА ДЛЯ ІН’ЄКЦІЙ |
розчинник для парентерального застосування по 5 мл в ампулі; по 5 ампул у блістері, по 2 блістери в пачці; по 2 мл в ампулі; по 10 ампул у блістері, по 1 блістеру в пачці |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів: приведення у відповідність до реєстраційних документів написання реєстраційного номера в наказі МОЗ України № 1194 від 29.05.2019 в процесі перереєстрації. З технічних обставин в проекті наказу не був зазначений реєстраційний номер. Редакція в наказі — реєстраційний номер відсутній. Запропонована редакція — UA/10078/01/01. |
Без рецепта |
UA/10078/01/01 |
| 30. |
ВОТРІЄНТ![™]() |
таблетки, вкриті плівковою оболонкою, по 200 мг, по 30 таблеток у флаконі, по 1 флакону в картонній коробці |
Новартіс Фарма АГ |
Швейцарія |
виробник нерозфасованої продукції: Глаксо Оперейшнс ЮК Лімітед, Велика Британія; виробник для пакування та випуску серії:
Глаксо Веллком С.А., Іспанія |
Велика Британія/Іспанія |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Взаємодія з іншими лікарськими засобами та інші види взаємодій», «Особливості застосування», «Побічні реакції». Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/12035/01/01 |
| 31. |
ВОТРІЄНТ![™]() |
таблетки, вкриті плівковою оболонкою, по 400 мг, по 30 таблеток у флаконі, по 1 флакону в картонній коробці |
Новартіс Фарма АГ |
Швейцарія |
виробник нерозфасованої продукції: Глаксо Оперейшнс ЮК Лімітед, Велика Британія; виробник для пакування та випуску серії:
Глаксо Веллком С.А., Іспанія |
Велика Британія/Іспанія |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Взаємодія з іншими лікарськими засобами та інші види взаємодій», «Особливості застосування», «Побічні реакції». Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/12035/01/02 |
| 32. |
ГЕКСАВІТ |
драже, по 50 драже у контейнерах (баночках); по 50 драже в контейнері (баночці), по 1 контейнеру (баночці) у пачці; по 1 кг драже в пакеті поліетиленовому подвійному |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання нового Сертифікату R0-CEP 2013-165-Rev 01 для АФІ Піридоксину гідрохлорид від вже затвердженого виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай, як наслідок вилучення зі специфікації АФІ контроль за показником «Важкі метали» для виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай |
Без рецепта |
UA/4914/01/01 |
| 33. |
ГЕКСАКСИМ/HEXAXIM ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ), ГЕПАТИТУ В РЕКОМБІНАНТНА, ПОЛІОМІЄЛІТУ ІНАКТИВОВАНА ТА ЗАХВОРЮВАНЬ, СПРИЧИНЕНИХ HAEMOPHILUS ТИПУ B КОН’ЮГОВАНА, АДСОРБОВАНА, РІДКА |
суспензія для ін’єкцій по 0,5 мл (1 доза) в попередньо заповнених шприцах з 1-єю (або 2-ма) окремими голками № 1 або № 10 та у флаконах № 10 |
Санофі Пастер С.А. |
Францiя |
ЗАТ «Санофі-Авентіс», Угорщина (вторинне пакування); Санофі Пастер С.А., Францiя (повний цикл виробництва, випуск серії) |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ — додавання випробування Residual dermonecrotic activity test для контролю якості на етапі випуску проміжного продукту нативного очищеного філаментного гемаглютиніну (FHA) та вилучення цього тесту при контролі якості на етапі випуску адсорбованого очищеного філаментного гемаглютиніну (FHA); звуження допустимих меж, визначених у специфікації для води, що використовується у процесі виробництва антигенів Bordetella pertussis з Water (purified) Ph.Eur.0008 на Water (highly purified) Ph.Eur.1927;
Зміни І типу — оновлення ГЕ-сертифікату відповідності Європейській фармакопеї для фетальної бичачої сироватки з R1-CEP 2000-155-Rew 03 (Invitrogen corporation) на R1-CEP 2000-155-Rew 04 (Life Technologies corporation) у зв’язку із зміною назви виробника; зміни II типу — зміни в процесі виробництва АФІ — оптимізація умов виробництва нативного очищеного FHA, яка проводиться для забезпечення видалення випробування Residual dermonecrotic activity test та внесення редакційних правок до розділів модуля 3: 3.2.S.2.2, 3.2.S.2.3, 3.2.S.2.4, 3.2.S.2.5, 3.2.S.2.6, 3.2.S.3.2, 3.2.S.4.1, 3.2.S.4.2, 3.2.S.4.3, 3.2.S.4.4, 3.2.S.4.5, 3.2.А.1, 3.2.А.1; заміна піногасника, який використовується у процесі ферментації антигенів Bordetella pertussis з DC1520 на Медичну піногасну С-емульсію від того ж постачальника |
За рецептом |
UA/13080/01/01 |
| 34. |
ГЕКСАСПРЕЙ |
спрей оромукозний, 750 мг/30 г, по 30 г у аерозольному флаконі; по 1 флакону в картонній коробці |
Лабораторії Бушара Рекордаті |
Францiя |
Лабораторії Бушара Рекордаті |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна будь-якої частини матеріалу первинної упаковки, що не контактує з готовим лікарським засобом (наприклад колір кришечок з контролем першого відкриття, колір кодових кілець на ампулах, контейнера для голок (різні види пластмаси) (зміна, яка не впливає на коротку характеристику лікарського засобу) Оновлення розділу 3.2.Р.7 Система контейнер/закупорювальний засіб; внесення змін у розпилювач (Spray applicator): видалення нефункціонального елементу — молдингу (додаткового пластикового кільця), який не контактує з готовим лікарським засобом. Матеріал розпилювача залишається без змін. |
Без рецепта |
UA/6180/01/01 |
| 35. |
ГІНО-ТАРДИФЕРОН |
таблетки, вкриті оболонкою, пролонгованної дії; по 10 таблеток у блістері; по 3 блістери у картонній коробці |
П’єр Фабр Медикамент |
Францiя |
П’єр Фабр Медикамент Продакшн |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактних даних уповноваженої особи відповідальної за здійснення фармаконагляду заявника. |
За рецептом |
UA/2976/01/01 |
| 36. |
ГЛОДУ НАСТОЙКА |
настойка, по 25 мл або по 50 мл, або по 100 мл у флаконах |
Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я» |
Україна |
Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) — зміна адреси заявника (Введення змін протягом 6-ти місяців після затвердження);
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна адреси виробника Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я», зміни внесені в розділи «Виробник» та «Місцезнаходження виробника та його адреса місця провадження діяльності» в інструкцію для медичного застосування лікарського засобу, як наслідок — відповідні зміни в тексті маркування упаковки лікарського засобу (Введення змін протягом 6-ти місяців після затвердження);
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна розміру упаковки готового лікарського засобу (вилучення упаковки певного розміру) — вилучено флакони полімерні по 50 мл та 100 мл та флакони із скла по 25 мл, по 50 мл та по 100 мл в картонній коробці з матеріалів реєстраційного досьє з відповідними змінами до розділу «Упаковка»; зміни внесені в розділ «Упаковка» в інструкцію для медичного застосування лікарського засобу у зв’язку з вилученням певного розміру упаковки, як наслідок — вилучення тексту маркування для відповідної упаковки лікарського засобу (Введення змін протягом 6-ти місяців після затвердження) |
Без рецепта |
UA/10638/01/01 |
| 37. |
ГРИПЕКС АКТИВ МАКС |
таблетки по 4 або 10, або 12 таблеток у блістері; по 1 блістеру в картонній коробці; по 10 або 12 таблеток у блістері; по 2 блістери в картонній коробці |
Юнілаб, ЛП |
США |
Евертоджен Лайф Саєнсиз Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактних даних контактної особи, відповідальної за здійснення фармаконагляду |
Без рецепта |
UA/11429/01/01 |
| 38. |
ДЕПАКІН® |
сироп, 57,64 мг/мл, № 1: по 150 мл у флаконі; по 1 флакону з дозуючим пристроєм з пробкою-адаптором в картонній коробці |
ТОВ «Санофі-Авентіс Україна» |
Україна |
Юнітер Ліквід Мануфекчурінг |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна параметрів специфікацій та/або допустимих меж первинної упаковки готового лікарського засобу —
доповнення специфікації новим показником з відповідним методом випробування «ІЧ-ідентифікація» для шприца з метою покращення якості шприца; доповнення специфікації новим показником з відповідним методом випробування «Вимірювальні тести»; доповнення специфікації новим показником з відповідним методом випробування «Пропускання світла» відповідно до діючої редакції ЕР «3.2.1. Скляна тара для фармацевтичного використання»; доповнення специфікації новим показником «Зовнішній вигляд» з відповідним методом випробування «Візуальний огляд»; доповнення специфікації новим показником з відповідним методом випробування «Перевірка об’єму» для шприца з метою покращення якості шприца; вилучення показника «Миш’як» із специфікації коричневого скляного флакону типу ІІІ;
Зміни І типу — зміна пристроїв для вимірювання дози або введення лікарського засобу — зміна маркування на дозуючому пристрої, доповнення дозуванням 57.64 мл мг/мл з отриманням нового сертифікату |
За рецептом |
UA/3817/01/01 |
| 39. |
ДИКЛОФЕНАК ЄВРО |
таблетки, вкриті оболонкою, кишковорозчинні по 50 мг по 10 таблеток у блістері, по 1, або по 2, або по 10 блістерів у коробці з картону |
«Юнік Фармасьютикал Лабораторіз» (відділення фірми «Дж. Б. Кемікалз енд Фармасьютикалз Лтд.») |
Індія |
Юнік Фармасьютикал Лабораторіз (відділення фірми «Дж. Б. Кемікалз енд Фармасьютикалз Лтд.») |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — оновлення вже затвердженого тексту маркування первинної та вторинної упаковки лікарського засобу а саме, вилучення з первинної упаковки тексту маркування англійською мовою та додавання знаку про рецептурне застосування лікарського засобу на вторинній упаковці. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/3939/03/01 |
| 40. |
ДИФЕРЕЛІН® |
порошок по 3,75 мг та розчинник для суспензії для ін’єкцій пролонгованого вивільнення, 1 флакон з порошком у комплекті з розчинником по 2 мл в ампулі, шприцом для одноразового використання та двома голками (у блістерній упаковці) у картонній коробці |
ІПСЕН ФАРМА |
Францiя |
порошок: виробництво та пакування: ІПСЕН ФАРМА БІОТЕК, Франція; гамма-випромінювання: ІПСЕН ФАРМА БІОТЕК, Франція; СТЕРІДЖЕНІКС ІТАЛІЯ С.П.А., Італiя; вторинне пакування, контроль якості та випуск лікарського засобу: ІПСЕН ФАРМА БІОТЕК, Франція; розчинник: виробництво, первинне пакування та контроль якості: СЕНЕКСІ, Франція; вторинне пакування та випуск серії:
ІПСЕН ФАРМА БІОТЕК, Франція |
Францiя/Італiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни випробувань або допустимих меж у процесі виробництва АФІ, що встановлені у специфікаціях (інші зміни) внесення змін до матеріалів реєстраційного досьє: оновлення р. 3.2.S.2.4. Контроль критичних стадій і проміжної продукції, включаючи оновлений метод ВЕРХ. |
За рецептом |
UA/0695/01/02 |
| 41. |
ДИФЕРЕЛІН® |
порошок по 0,1 мг та розчинник для розчину для ін’єкцій, по 7 флаконів з порошком та 7 ампул з 1 мл розчинника (розчин натрію хлориду 0,9%) у картонній коробці |
ІПСЕН ФАРМА |
Францiя |
порошок — виробництво, тестування, пакування, випуск серії: ІПСЕН ФАРМА БІОТЕК, Франція; розчинник — виробництво, первинне пакування та контроль якості: СЕНЕКСІ, Франція; вторинне пакування, випуск серії: ІПСЕН ФАРМА БІОТЕК, Франція |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни випробувань або допустимих меж у процесі виробництва АФІ, що встановлені у специфікаціях (інші зміни) внесення змін до матеріалів реєстраційного досьє: оновлення р. 3.2.S.2.4. Контроль критичних стадій і проміжної продукції, включаючи оновлений метод ВЕРХ. |
За рецептом |
UA/0695/02/01 |
| 42. |
ДІАЗОЛІН-СБ-ФАРМА |
драже по 50 мг; по 10 драже у блістері; по 2 блістери в пачці з картону |
ТОВ «ФОРС-ФАРМА ДИСТРИБЮШН» |
Україна |
ПАТ «Вітаміни» |
Україна |
внесення змін до реєстраційних матеріалів: зміна заявника (власника реєстраційного посвідчення) (згідно наказу МОЗ від 23.07.2015 № 460);
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — зміна уповноваженої особи, відповідальної за фармаконагляд: діюча редакція — Щиголєва Маріанна Вікторівна, пропонована редакція — Іщук Наталка Петрівна. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна місця (адреси) здійснення основної діяльності з фармаконагляду, місцезнаходження мастер-файла системи фармаконагляду заявника |
Без рецепта |
UA/15429/01/02 |
| 43. |
ДІАЗОЛІН-СБ-ФАРМА |
драже по 100 мг; по 10 драже у блістері; по 2 блістери в пачці з картону |
ТОВ «ФОРС-ФАРМА ДИСТРИБЮШН» |
Україна |
ПАТ «Вітаміни» |
Україна |
внесення змін до реєстраційних матеріалів: зміна заявника (власника реєстраційного посвідчення) (згідно наказу МОЗ від 23.07.2015 № 460);
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — зміна уповноваженої особи, відповідальної за фармаконагляд: діюча редакція — Щиголєва Маріанна Вікторівна, пропонована редакція — Іщук Наталка Петрівна. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна місця (адреси) здійснення основної діяльності з фармаконагляду, місцезнаходження мастер-файла системи фармаконагляду заявника |
Без рецепта |
UA/15429/01/01 |
| 44. |
ДОКСОРУБІЦИН «ЕБЕВЕ» |
концентрат для розчину для інфузій, 2 мг/мл; по 5 мл (10 мг), по 25 мл (50 мг), по 50 мл (100 мг), або по 100 мл (200 мг) у флаконі; по 1 флакону в картонній коробці |
ЕБЕВЕ Фарма Гес.м.б.Х. Нфг. КГ |
Австрія |
ЕБЕВЕ Фарма Гес.м.б.Х. Нфг. КГ |
Австрія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу (інші зміни) Збільшення часу фільтрації в процесі виробництва ГЛЗ (з ≤ 13 годин до ≤ 24 години). |
За рецептом |
UA/1379/01/01 |
| 45. |
ДОКСТОРЕД |
концентрат для розчину для інфузій, 20 мг/мл; по 1 мл (20 мг) або 4 мл (80 мг) у флаконі, по 1 флакону у пластиковому лотку у картонній коробці |
Д-р Редді’с Лабораторіс Лтд |
Індія |
Д-р Редді’с Лабораторіс Лтд (Виробничий відділ — 7) |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб (інші зміни) — приведення опису упаковки готового лікарського засобу (введення проміжної упаковки — пластикового лотка) у відповідність до матеріалів реєстраційного досьє. Матеріал первинної упаковки залишається незмінним (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/16701/01/01 |
| 46. |
ЕВЕРОЛІМУС-ВІСТА |
таблетки по 2,5 мг по 5 таблеток у блістері; по 6 блістерів у картонній коробці |
ТОВ «Фармацевтична компанія Віста» |
Україна |
первинне, вторинне пакування, контроль якості, випуск серії: Сінтон Хіспанія, С. Л. Іспанія, виробництво, первинне, вторинне пакування: Сінтон Чилі Лтда. Чилі |
Іспанія/Чилі |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за фармаконагляд: Діюча редакція: Дубач Тетяна Вікторівна; Пропонована редакція: Сотнікова Світлана Вікторівна. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/17149/01/01 |
| 47. |
ЕВЕРОЛІМУС-ВІСТА |
таблетки по 5 мг по 5 таблеток у блістері; по 6 блістерів у картонній коробці |
ТОВ «Фармацевтична компанія Віста» |
Україна |
первинне, вторинне пакування, контроль якості, випуск серії: Сінтон Хіспанія, С. Л. Іспанія, виробництво, первинне, вторинне пакування: Сінтон Чилі Лтда. Чилі |
Іспанія/Чилі |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за фармаконагляд: Діюча редакція: Дубач Тетяна Вікторівна; Пропонована редакція: Сотнікова Світлана Вікторівна. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/17149/01/02 |
| 48. |
ЕВЕРОЛІМУС-ВІСТА |
таблетки по 10 мг по 5 таблеток у блістері; по 6 блістерів у картонній коробці |
ТОВ «Фармацевтична компанія Віста» |
Україна |
первинне, вторинне пакування, контроль якості, випуск серії: Сінтон Хіспанія, С. Л. Іспанія, виробництво, первинне, вторинне пакування: Сінтон Чилі Лтда. Чилі |
Іспанія/Чилі |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за фармаконагляд: Діюча редакція: Дубач Тетяна Вікторівна; Пропонована редакція: Сотнікова Світлана Вікторівна. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/17149/01/03 |
| 49. |
ЕКОНАЗОЛУ НІТРАТ |
порошок (субстанція) у пакетах подвійних поліетиленових для фармацевтичного застосування |
ТОВ «ФАРМЕКС ГРУП» |
Україна |
ПМС ІЗОХЕМ |
Франція |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника (включаючи, за необхідності, місце проведення контролю якості), або власника мастер-файла на АФІ, або постачальника АФІ/вихідного матеріалу/реагенту/проміжного продукту, що застосовуються у виробництві АФІ (якщо зазначено у досьє на лікарський засіб) за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє, або виробника нової допоміжної речовини (якщо зазначено у досьє) — зміна назви та адреси виробника АФІ (Еконазолу нітрату) |
— |
UA/13577/01/01 |
| 50. |
ЕЛЕУТЕРОКОКА ЕКСТРАКТ РІДКИЙ |
екстракт рідкий (субстанція) у бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції |
— |
UA/9750/01/01 |
| 51. |
ЕЛОНВА |
розчин для ін’єкцій по 100 мкг/0,5 мл; по 0,5 мл розчину в попередньо наповненому шприці; по 1 попередньо наповненому шприцу разом зі стерильною ін’єкційною голкою у відкритому пластиковому лотку в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Веттер Фарма-Фертигунг ГмбХ і Ко.КГ, Німеччина (Візуальна інспекція); Веттер Фарма-Фертигунг ГмбХ і Ко КГ, Німеччина (Контроль якості, тестування стерильності та бактеріальних ендотоксинів готового лікарського засобу (контроль якості), візуальна інспекція); Веттер Фарма-Фертигунг ГмбХ i Ко. КГ, Німеччина (Виробництво нерозфасованої продукції та первинна упаковка, контроль якості, тестування стерильності та бактеріальних ендотоксинів готового лікарського засобу (контроль якості), візуальна інспекція); Н.В. Органон, Нiдерланди (контроль якості та тестування стабільності, вторинна упаковка, дозвіл на випуск серії) |
Німеччина/Нiдерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — зміни у методах випробування АФІ т. Визначення похідних білків клітин яєчника китайського хом’ячка (метод ферментативного аналізу (СНО-ЕІА)) додавання альтернативного постачальника «Sera Care» для реагентів 3,3,5,5 — тетраметилбензидину (ТМВ) та пероксиду сечовини (UP);
Зміни І типу — зміна у методах випробування готового лікарського засобу АФІ т. Імуноактивність (ЕІСА-СА) — зміни пробопідготовки стандартних зразків, робочих розчинів (використання свіжого контрольного зразка та стандарту порівняння замість заморожених зразків) |
За рецептом |
UA/13125/01/01 |
| 52. |
ЕЛОНВА |
розчин для ін’єкцій по 150 мкг/0,5 мл; по 0,5 мл розчину в попередньо наповненому шприці; по 1 попередньо наповненому шприцу разом зі стерильною ін’єкційною голкою у відкритому пластиковому лотку в картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Веттер Фарма-Фертигунг ГмбХ і Ко.КГ, Німеччина (Візуальна інспекція); Веттер Фарма-Фертигунг ГмбХ і Ко КГ, Німеччина (Контроль якості, тестування стерильності та бактеріальних ендотоксинів готового лікарського засобу (контроль якості), візуальна інспекція); Веттер Фарма-Фертигунг ГмбХ i Ко. КГ, Німеччина (Виробництво нерозфасованої продукції та первинна упаковка, контроль якості, тестування стерильності та бактеріальних ендотоксинів готового лікарського засобу (контроль якості), візуальна інспекція); Н.В. Органон, Нiдерланди (контроль якості та тестування стабільності, вторинна упаковка, дозвіл на випуск серії) |
Німеччина/Нiдерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — зміни у методах випробування АФІ т. Визначення похідних білків клітин яєчника китайського хом’ячка (метод ферментативного аналізу (СНО-ЕІА)) додавання альтернативного постачальника «Sera Care» для реагентів 3,3,5,5 — тетраметилбензидину (ТМВ) та пероксиду сечовини (UP);
Зміни І типу — зміна у методах випробування готового лікарського засобу АФІ т. Імуноактивність (ЕІСА-СА) — зміни пробопідготовки стандартних зразків, робочих розчинів (використання свіжого контрольного зразка та стандарту порівняння замість заморожених зразків) |
За рецептом |
UA/13125/01/02 |
| 53. |
ЕРМУЦИН® |
тверді капсули по 300 мг по 10 капсул у блістері; по 2 або по 6 блістерів у коробці з картону |
УАБ «МРА» |
Литовська Республіка |
виробництво нерозфасованої продукції, контроль та випуск серій: ЕДМОНД ФАРМА С.Р.Л., Італiя; первинне та вторинне пакування:
ЛАМП САН ПРОСПЕРО СПА, Італія |
Італія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за здійснення фармаконагляду Заявника. Діюча редакція — Martynas Juzenas. Пропонована редакція — Gediminas Zvicevicius. Зміна контактних даних уповноваженої особи |
За рецептом |
UA/14088/01/01 |
| 54. |
ЕРМУЦИН® |
порошок для оральної суспензії, 175 мг/5 мл, 1 флакон з порошком з мірним контейнером у коробці з картону |
УАБ «МРА» |
Литовська Республіка |
Вторинне пакування, випуск серії:
Анжеліні Фарма Чеська республіка с.р.о., Чеська Республiка
Виробництво нерозфасованої продукції, первинне пакування, контроль серії/тестування наповнених флаконів:
Фултон Медициналі С.п.А., Італія
Додатковий контроль серії /тестування наповнених флаконів:
Едмонд Фарма С.р.л., Італiя |
Чеська республіка/ Італія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за здійснення фармаконагляду Заявника. Діюча редакція — Martynas Juzenas. Пропонована редакція — Gediminas Zvicevicius. Зміна контактних даних уповноваженої особи. |
За рецептом |
UA/14153/01/01 |
| 55. |
ЕСМЕРОН® |
розчин для ін’єкцій, 10 мг/мл; по 5 мл (50 мг) у флаконі; по 10 флаконів у картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво in bulk, первинне/вторинне пакування, контроль якості та випуск серії:Н.В. Органон, Нідерланди;Виробництво in bulk, первинне пакування та контроль якості:Сігфрід Хамельн ГмбХ, Німеччина;Альтернативний контроль якості:Хамельн рдс а.с., Словаччина |
Нідерланди/Німеччина/Словаччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) Уточнення адреси заявника (власника реєстраційного посвідчення) |
За рецептом |
UA/7719/01/01 |
| 56. |
ЕСМЕРОН® |
розчин для ін’єкцій, 10 мг/мл; по 5 мл (50 мг) у флаконі; по 10 флаконів у картонній коробці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво in bulk, первинне/вторинне пакування, контроль якості та випуск серії:
Н.В. Органон, Нідерланди
Виробництво in bulk, первинне пакування та контроль якості:
Сігфрід Хамельн ГмбХ, Німеччина
Альтернативний контроль якості:
Хамельн рдс а.с., Словаччина |
Нідерланди/ Німеччина/ Словаччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна місця здійснення основної діяльності з фармаконагляду.
Зміна місцезнаходження майстер-файла |
За рецептом |
UA/7719/01/01 |
| 57. |
ЕФЕРАЛГАН |
супозиторії ректальні по 80 мг по 5 супозиторіїв у блістері; по 2 блістери в картонній коробці |
УПСА САС |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника, для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/5237/03/01 |
| 58. |
ЕФЕРАЛГАН |
супозиторії ректальні по 150 мг по 5 супозиторіїв у блістері; по 2 блістери в картонній коробці |
УПСА САС, |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника, для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/5237/03/02 |
| 59. |
ЕФЕРАЛГАН |
супозиторії ректальні по 300 мг по 5 супозиторіїв у блістері; по 2 блістери в картонній коробці |
УПСА САС |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника, для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/5237/03/03 |
| 60. |
ЕХІНАЦЕЇ ПУРПУРОВОЇ НАСТОЙКА |
настойка (субстанція) в бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції. |
— |
UA/12517/01/01 |
| 61. |
ЗВІРОБОЮ НАСТОЙКА |
настойка (субстанція) в бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції |
— |
UA/12515/01/01 |
| 62. |
ЗЕРБАКСА® |
порошок для концентрату для розчину для інфузій, 1 г/0,5 г; по 10 флаконів з порошком у картонній коробці |
Мерк Шарп і Доум ІДЕА ГмбХ |
Швейцарія |
виробництво за повним цикломСтері-Фарма, ЛЛС, США;альтернативний виробник: вторинне пакування, відповідальний за випуск серіїЛабораторії Мерк Шарп і Доум Шибре, Франція |
США/Франція |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) — зміна назви та адреси заявника |
За рецептом |
UA/16362/01/01 |
| 63. |
ЗИОМІЦИН® |
таблетки, вкриті оболонкою, по 250 мг по 6 або по 21 таблетці у блістері; по 1 блістеру у картонній упаковці |
КУСУМ ХЕЛТХКЕР ПВТ ЛТД |
Індія |
КУСУМ ХЕЛТХКЕР ПВТ ЛТД, Індія
або
ТОВ «КУСУМ ФАРМ», Україна |
Індія/Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (збільшення до 10 разів порівняно із затвердженим розміром) введення додаткового розміру серії ГЛЗ для виробника ТОВ «КУСУМ ФАРМ», Україна для дозування 250 мг. Затверджено: Розмір серії: 100 000 таблеток Запропоновано: Розмір серії: 100 000 таблеток 200 000 таблеток |
За рецептом |
UA/10672/01/01 |
| 64. |
ЗИОМІЦИН® |
таблетки, вкриті оболонкою, по 500 мг по 3 таблетки у блістері; по 1 блістеру у картонній упаковці |
КУСУМ ХЕЛТХКЕР ПВТ ЛТД |
Індія |
КУСУМ ХЕЛТХКЕР ПВТ ЛТД, Індія
або
ТОВ «КУСУМ ФАРМ», Україна |
Індія/Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (збільшення до 10 разів порівняно із затвердженим розміром) введення додаткового розміру серії ГЛЗ для виробника ТОВ «КУСУМ ФАРМ», Україна для дозування 250 мг. Затверджено: Розмір серії: 100 000 таблеток Запропоновано: Розмір серії: 100 000 таблеток 200 000 таблеток |
За рецептом |
UA/10672/01/02 |
| 65. |
ЗОКОР® ФОРТЕ |
таблетки вкриті плівковою оболонкою по 40 мг по 14 таблеток у блістері; по 2 блістери в картонній коробці |
Мерк Шарп і Доум Ідеа Інк |
Швейцарія |
Виробник нерозфасованої продукції, контроль якості:
Мерк Шарп і Доум Лімітед, Велика Британія
Пакування, випуск серії:
Мерк Шарп і Доум Б.В., Нідерланди |
Велика Британія/Нідерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/0645/01/01 |
| 66. |
ЗОЛЕВ-500 |
таблетки, вкриті плівковою оболонкою, по 500 мг, по 5 таблеток у блістері; по 1 блістеру у картонній коробці |
Євро Лайфкер Прайвіт Лімітед |
Індія |
ФДС Лімітед |
Індія |
внесення змін до реєстраційних матеріалів: зміна заявника (власника реєстраційного посвідчення) (згідно наказу МОЗ від 23.07.2015 № 460) Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/8777/01/02 |
| 67. |
ЗОЛЕВ-500 |
таблетки, вкриті плівковою оболонкою, по 500 мг по 5 таблеток у блістері; по 1 блістеру в коробці |
Євро Лайфкер Лтд |
Велика Британiя |
ФДС Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Вилучення дозування 250 мг з матеріалів реєстраційного досьє. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/8777/01/02 |
| 68. |
ЗОЛЕВ-750 |
таблетки, вкриті плівковою оболонкою, по 750 мг, по 5 таблеток у блістері; по 1 блістеру у картонній коробці |
Євро Лайфкер Прайвіт Лімітед |
Індія |
ФДС Лімітед |
Індія |
внесення змін до реєстраційних матеріалів: зміна заявника (власника реєстраційного посвідчення) (згідно наказу МОЗ від 23.07.2015 № 460) Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/8777/01/03 |
| 69. |
ЗОЛЕВ-750 |
таблетки, вкриті плівковою оболонкою, по 750 мг по 5 таблеток у блістері; по 1 блістеру в коробці |
Євро Лайфкер Лтд |
Велика Британiя |
ФДС Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Вилучення дозування 250 мг з матеріалів реєстраційного досьє. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/8777/01/03 |
| 70. |
ЗОУЛІ |
таблетки, вкриті плівковою оболонкою, 2,5 мг/1,5 мг по 28 таблеток у блістері (24 (активні) таблетки білого кольору та 4 (плацебо) таблетки жовтого кольору); по 1 блістеру в картонній коробці разом з календарем наклейкою з днями тижня |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво нерозфасованої продукції, первинна та вторинна упаковка, контроль якості та тестування стабільності:Дельфарм Ліль САС, Францiя;Контроль якості та тестування стабільності:Н.В. Органон, Нідерланди;Випуск серії:Мерк Шарп і Доум Б.В., Нідерланди |
Франція/Нідерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) — уточнення адреси заявника (власника реєстраційного посвідчення) |
За рецептом |
UA/14120/01/01 |
| 71. |
ЗОУЛІ |
таблетки, вкриті плівковою оболонкою, 2,5 мг/1,5 мг
по 28 таблеток у блістері(24 (активні) таблетки білого кольору та 4 (плацебо) таблетки жовтого кольору); по 1 блістеру в картонній коробці разом з календарем наклейкою з днями тижня |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво нерозфасованої продукції, первинна та вторинна упаковка, контроль якості та тестування стабільності:
Дельфарм Ліль САС, Францiя
Контроль якості та тестування стабільності:
Н.В. Органон, Нідерланди
Випуск серії:
Мерк Шарп і Доум Б.В., Нідерланди |
Францiя/Нідерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна постачальника пакувальних матеріалів або комплектуючих (якщо зазначено в досьє) (вилучення постачальника) Оновлений розділ 3.2.Р.7. Система контейнер/закупорювальний засіб: видалення інформації щодо постачальників пакувального матеріалу та об’єднання 3 окремих додатків щодо пакувальних матеріалів в єдиний розділ. |
За рецептом |
UA/14120/01/01 |
| 72. |
ІЗО-МІК® 5 МГ |
таблетки сублінгвальні по 5 мг по 50 таблеток у банці, по 1 банці у пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
ТОВ НВФ «МІКРОХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування готового лікарського засобу (інші зміни у методах випробувань (включаючи заміну або доповнення)) |
За рецептом |
UA/3186/03/01 |
| 73. |
ІЛОН® КЛАСІК |
мазь, по 25 г, 50 г, 100 г у тубі № 1 |
Цесра Арцнайміттель ГмбХ і Ко. КГ |
Німеччина |
Випуск серії:
Цесра Арцнайміттель ГмбХ і Ко. КГ, Німеччина
Виробництво нерозфасованого продукту, первинне та вторинне пакування:
етол Гезундхайтспфлеге- унд Фармапродукте ГмбХ, Німеччина |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду внесення змін до реєстраційних матеріалів:заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна контактної особи заявника, відповідальної за здійснення фармаконагляду в Україні. Діюча редакція: Красовський Тимур Леонідович. Пропонована редакція: Войтенко Антон Георгійович. Зміна контактних даних контактної особи заявника, відповідальної за здійснення фармаконагляду в Україні. |
Без рецепта |
UA/16843/01/01 |
| 74. |
ІНФАНРИКС![™]() ІПВ ХІБ/INFANRIX ІПВ ХІБ/INFANRIX![™]() IPV HIB КОМБІНОВАНА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ), ПОЛІОМІЄЛІТУ ТА ЗАХВОРЮВАНЬ, ЗБУДНИКОМ ЯКИХ Є HAEMOPHILUS INFLUENZAE ТИПУ B IPV HIB КОМБІНОВАНА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ), ПОЛІОМІЄЛІТУ ТА ЗАХВОРЮВАНЬ, ЗБУДНИКОМ ЯКИХ Є HAEMOPHILUS INFLUENZAE ТИПУ B |
суспензія (DTPa-IPV) для ін’єкцій по 0,5 мл (1 доза) та ліофілізат (Hib), cуспензія (DTPa-IPV) для ін’єкцій по 0,5 мл (1 доза) у попередньо наповненому одноразовому шприці № 1 у комплекті з двома голками та ліофілізат (Hib) у флаконі № 1, що змішуються перед використанням: по 1 попередньо наповненому одноразовому шприцу у комплекті з двома голками та 1 флаконом з ліофілізатом (Hib) у вакуумній стерильній упаковці; по 1 вакуумній стерильній упаковці у картонній коробці з маркуванням українською мовою |
ГлаксоСмітКляйн Експорт Лімітед |
Велика Британiя |
ГлаксоСмітКляйн Біолоджікалз С.А. |
Бельгiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — узгодження матеріалів реєстраційного досьє з виробничою практикою щодо документації, яка використовується при контролі якості при виробництві проміжного продукту інактивованого моновалентного поліовірусу (IPV). Внесення редакційних правок до розділу 3.2.S.2.4 |
За рецептом |
UA/15832/01/01 |
| 75. |
ІНФЕЗОЛ® 40 |
розчин для інфузій по 250 мл або по 500 мл у флаконі; по 10 флаконів у картонній коробці |
БЕРЛІН-ХЕМІ АГ |
Німеччина |
БЕРЛІН-ХЕМІ АГ |
Німеччина |
внесення змін до реєстраційних матеріалів: зміни I типу — зміни у методах випробування готового лікарського засобу т. Кількісне визначення ксиліту додавання альтернативного методу титрування натрію гідроксидом (варіант 2) до вже затвердженого титрування натрію тіосульфатом (варіант 1), т. Ідентифікація іонів калію, натрію додавання альтернативного методу Атомно-емісійної спектрометрії до вже затвердженого Атомно-абсорбційної спектрометрії, т. Кількісне визначення іонів натрію, калію додавання альтернативного методу Полум’яної Атомно-емісійної спектрометрії до вже затвердженого методу Атомно-абсорбційної спектрометрія; редакційні правки, т. Кількісне визначення іонів магнію додавання альтернативного методу Атомно-абсорбційної спектрометрія (варіант 1) до вже затвердженого методу Атомно-абсорбційної спектрометрія (варіант 2). Введення змін протягом 6-ти місяців після затвердження; зміни I типу — зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу — зміни випробувань у процесі виробництва — вилучення вмісту іонів калію, натрію, магнію, ксиліту, оскільки контроль проводиться на випуск серії готового лікарського засобу; зміни I типу — зміна у методах випробування первинної упаковки готового лікарського засобу — додавання альтернативного методу контролю за т. загальний вміст золи для гумових пробок (in-house) до вже затвердженого методу (ЕР. 3.2.9); зміни II типу — зміна у первинній упаковці готового лікарського засобу — зміни якісного та кількісного складу гумових пробок |
За рецептом |
UA/0192/01/02 |
| 76. |
ІНФЕЗОЛ® 40 |
розчин для інфузій по 250 мл або по 500 мл у флаконі; по 10 флаконів у картонній коробці |
БЕРЛІН-ХЕМІ АГ |
Німеччина |
БЕРЛІН-ХЕМІ АГ |
Німеччина |
внесення змін до реєстраційних матеріалів (повторний розгляд): зміни I типу: Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) — збільшення терміну придатності для ГЛЗ. Затверджено: 24 місяці. Запропоновано: 36 місяців. Введення змін протягом 6-ти місяців після затвердження. Зміни I типу: Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (зміна в умовах зберігання готового лікарського засобу або після розчинення/відновлення) — зміна в умовах зберігання готового лікарського засобу, а саме Затверджено: «Зберігати при температурі не вище 25°С та у захищеному від дії світла місці!». Запропоновано: «Зберігати при температурі не вище 30°С! Зберігати флакони у зовнішній упаковці від дії світла». «Не заморожувати!» Зміни внесені в інструкцію для медичного застосування у рр. «Термін придатності» та «Умови зберігання», як наслідок — відповідні зміни у текст маркування упаковки лікарського засобу. Введення змін протягом 6-ти місяців після затвердження. |
За рецептом |
UA/0192/01/02 |
| 77. |
ІРИНОТЕКАН-ВІСТА |
концентрат для приготування розчину для інфузій, 20 мг/мл по 5 мл (100 мг) або по 15 мл (300 мг), або 25 мл (500 мг) у флаконі; по 1 флакону в картонній коробці |
Містрал Кепітал Менеджмент Лімітед |
Англія |
Актавіс Італія С.п.А. |
Італія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — уточнення адреси виробника Актавіс Італія С.п.А., Італія без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/14240/01/01 |
| 78. |
КАМФОРНА ОЛІЯ |
олія для зовнішнього застосування 10%, по 30 мл у флаконах; по 30 мл у флаконі, по 1 флакону в пачці з картону |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна назви виробника АФІ Камфори рацемічної, без зміни місця виробництва |
Без рецепта |
UA/0725/01/01 |
| 79. |
КАРВІДОН-MR |
таблетки, вкриті плівковою оболонкою з модифікованим вивільненням по 35 мг по 10 таблеток у блістері; по 10 блістерів в картонній пачці |
Мікро Лабс Лімітед |
Індія |
Мікро Лабс Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (інші зміни) зміна розміру серії ГЛЗ
затверджено: мінімальний розмір серії 150 000 таблеток — максимальний розмір серії 1 500 000 таблеток;
запропоновано: 500 000 таблеток (5000 упаковок) |
За рецептом |
UA/14874/01/01 |
| 80. |
КАРІЗОН |
розчин нашкірний 0,5 мг/1 г по 15 мл або 30 мл або 50 мл у флаконі з крапельницею та ковпачком; по 1 флакону в картонній пачці |
Дермафарм АГ |
Німеччина |
мібе ГмбХ Арцнайміттель |
Нiмеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміна у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування на підставі регулярно оновлюваного звіту з безпеки лікарського засобу, або досліджень з безпеки застосування лікарського засобу в післяреєстраційний період, або як результат оцінки звіту з досліджень, проведених відповідно до плану педіатричних досліджень (РІР) (зміну узгоджено з компетентним уповноваженим органом) — зміни внесені до інструкції у розділи: «Особливості застосування», «Побічні реакції» — згідно з даними щодо безпеки діючої речовини. Уточнено формулювання фармакотерапевтичної групи згідно з класифікатором фарм. груп. і кодів АТХ ВООЗ. З інструкції вилучено інформацію про заявника; зміни II типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування у зв’язку із новими даними з якості, доклінічними, клінічними даними та даними з фармаконагляду — зміни внесені до інструкції у розділ «Показання»; та розділи: «Фармакологічні властивості», «Протипоказання», «Взаємодія з іншими лікарськими засобами та інші види взаємодій», «Особливості застосування» (у т. ч. «Застосування у період вагітності або годування груддю», «Здатність впливати на швидкість реакції при керуванні автотранспортом іншими механізмами», «Спосіб застосування та дози» (у т. ч. «Діти»), «Передозування», «Побічні реакції»; Розділ «Діти». Зміни згідно з матеріалами реєстраційного досьє. |
За рецептом |
UA/10950/01/01 |
| 81. |
КВІТІВ РОМАШКИ ЕКСТРАКТ РІДКИЙ |
екстракт рідкий (субстанція) в бочках полімерних з кришками для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції |
— |
UA/12458/01/01 |
| 82. |
КЕТОРОЛАК-МІКРОХІМ |
розчин для ін’єкцій, 30 мг/мл, по 1 мл в ампулі, по 5 ампул у касеті, по 2 касети у пачці з картону |
Товариство з обмеженою відповідальністю Науково-виробнича фірма «МІКРОХІМ» |
Україна |
відповідальний за виробництво та контроль/випробування серії, не включаючи випуск серії:Приватне акціонерне товариство «Лекхім-Харків»,Україна;відповідальний за випуск серії, не включаючи контроль/випробування серії:Товариство з обмеженою відповідальністю Науково-виробнича фірма «МІКРОХІМ»,Україна |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) — вилучення виробничої дільниці «Товариство з обмеженою відповідальністю Науково-виробнича фірма «МІКРОХІМ» (лабораторія біологічного аналізу)» для готового лікарського засобу за адресою: Україна, 93009, Луганська обл., м. Рубіжне, вул. Почаївська, 9 (залишилась затверджена виробнича дільниця Приватне акціонерне товариство «Лекхім-Харків», що виконує таку саму функцію, що й вилучений) Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/17057/01/01 |
| 83. |
КЛЕКСАН® |
розчин для ін’єкцій, 10 000 анти-Ха МО/мл, № 10 (2х5): по 0,2 мл у шприц-дозі із захисною системою голки, по 2 шприц-дози у блістері, по 5 блістерів у картонній коробці; по 0,4 мл у шприц-дозі із захисною системою голки; по 2 шприц-дози у блістері; по 5 блістерів у картонній коробці |
ТОВ «Санофі-Авентіс Україна» |
Україна |
САНОФІ ВІНТРОП ІНДАСТРІА |
Францiя |
внесення змін до реєстраційних матеріалів:внесення змін до реєстраційних матеріалів:зміни II типу — зміни в процесі виробництва АФІ (зміна стосується активної речовини біологічного/імунологічного походження або використання хімічних АФІ у виробництві лікарського засобу біологічного/імунологічного походження, яка може мати значний вплив на якість, безпеку та ефективність лікарського засобу, і не стосується протоколу) |
За рецептом |
UA/7182/01/01 |
| 84. |
КЛЕКСАН® 300 |
розчин для ін’єкцій по 10 000 анти-Ха МО/мл № 1 (по 1 багатодозовому флакону по 3 мл в картонній коробці) |
ТОВ «Санофі-Авентіс Україна» |
Україна |
Санофі-Авентіс Дойчланд ГмбХ, Німеччина
ФАМАР ХЕЛС КЕАР СЕРВІСІЗ МАДРИД, С.А.У., Іспанiя |
Німеччина/ Іспанiя |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни в процесі виробництва АФІ (зміна стосується активної речовини біологічного/імунологічного походження або використання хімічних АФІ — введення додаткового процесу виробництва АФІ, який буде використовуватися на останньому етапі сушіння АФІ для дільниці Aventis Pharma Manufacturing Pte Ltd., Singapore, а саме: додавання процесу відновлення шляхом розчинення в депірогенній очищеній воді залишків еноксипарину натрію, які залишилися в розпилювальній сушарці, спрямоване на підвищення продуктивності процесу виробництва шляхом збору АФІ, яка попередньо втрачалася при очищенні обладнання |
За рецептом |
UA/10143/01/01 |
| 85. |
КЛОДИФЕН |
розчин для ін’єкцій, 25 мг/мл по 3 мл у ампулах, по 5 ампул у контурній чарунковій упаковці; 1 контурна чарункова упаковка в картонній коробці |
УОРЛД МЕДИЦИН ІЛАЧ САН. ВЕ ТІДЖ. A.Ш. |
Туреччина |
Мефар Ілач Сан. А.Ш. |
Туреччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи відповідальної за фармаконагляд: Діюча редакція: Хюсейн Тоніялі/Mr. Huseyin Tonyali. Пропонована редакція: Мевсім Ількбахар Дінчель/Mrs. Mevsim Ilkbahar Dincel. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна контактних даних контактної особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла. |
За рецептом |
UA/16930/01/01 |
| 86. |
КЛОДІЯ |
таблетки, вкриті плівковою оболонкою, по 75 мг по 10 таблеток у блістері; по 3 або 10 блістерів у пачці з картону |
Алвоген ІПКо С.ар.л. |
Люксембург |
виробництво, первинне та вторинне пакування:
ФАРМАТЕН С.А., Греція;
виробництво, первинне та вторинне пакування, випуск серії:
ФАРМАТЕН ІНТЕРНЕШНЛ СА, Грецiя |
Грецiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) — вилучення виробничої дільниці ГЛЗ відповідальної за випуск серії — ФАРМАТЕН С.А., Греція |
За рецептом |
UA/13673/01/01 |
| 87. |
КОЛЕДАН |
краплі оральні, розчин по 10 мл у флаконі крапельниці; по 1 флакону в картонній коробці |
УОРЛД МЕДИЦИН ІЛАЧ САН. ВЕ ТІДЖ. A.Ш. |
Туреччина |
УОРЛД МЕДИЦИН ІЛАЧ САН. ВЕ ТІДЖ. A.Ш. |
Туреччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи відповідальної за фармаконагляд: Діюча редакція: Хюсейн Тоніялі/Mr. Huseyin Tonyali. Пропонована редакція: Мевсім Ількбахар Дінчель/Mrs. Mevsim Ilkbahar Dincel. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна контактних даних контактної особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/16448/01/01 |
| 88. |
КОЛОМІЦИН ІН’ЄКЦІЯ |
порошок для розчину для ін’єкцій, інфузій або інгаляцій по 1 000 000 МО 10 флаконів з порошком в картонній коробці |
ТОВ «Тева Україна» |
Україна |
Виробництво нерозфасованого продукту, первинна упаковка, контроль серії:
Кселія Фармасьютікелз АпС, Данія;
Вторинна упаковка, дозвіл на випуск серії:
Пен Фармасьютікал Сервісез Лімітед, Велика Британія;
контроль серії:
Кселія Фармасьютікелз Лтд., Угорщина |
Данія/Велика Британія/Угорщина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна імпортера/зміни, що стосуються випуску серії та контролю якості готового лікарського засобу (заміна або додавання дільниці, на якій здійснюється контроль/випробування серії) — додавання дільниці, на якій здійснюється контроль серії Кселія Фармасьютікелз Лтд., Угорщина.
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ (за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє)(зміни до заходів, пов’язаних з контролем АФІ, або додавання дільниці, де проводиться контроль/випробування серії) — внесення змін до матеріалів реєстраційного досьє р. 3.2.S.2.1. Виробники: введення додаткової альтернативної дільниці, на якій здійснюється контроль якості та дослідження стабільності для АФІ Колістиметату натрію Кселія Фармасьютікелз Лтд., Угорщина |
За рецептом |
UA/7533/01/01 |
| 89. |
КОЛОМІЦИН ІН’ЄКЦІЯ |
порошок для розчину для ін’єкцій, інфузій або інгаляцій по 2 000 000 МО 10 флаконів з порошком в картонній коробці |
ТОВ «Тева Україна» |
Україна |
Виробництво нерозфасованого продукту, первинна упаковка, контроль серії:
Кселія Фармасьютікелз АпС, Данія;
Вторинна упаковка, дозвіл на випуск серії:
Пен Фармасьютікал Сервісез Лімітед, Велика Британія;
контроль серії:
Кселія Фармасьютікелз Лтд., Угорщина |
Данія/Велика Британія/Угорщина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна імпортера/зміни, що стосуються випуску серії та контролю якості готового лікарського засобу (заміна або додавання дільниці, на якій здійснюється контроль/випробування серії) — додавання дільниці, на якій здійснюється контроль серії Кселія Фармасьютікелз Лтд., Угорщина.
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ (за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє)(зміни до заходів, пов’язаних з контролем АФІ, або додавання дільниці, де проводиться контроль/випробування серії) — внесення змін до матеріалів реєстраційного досьє р. 3.2.S.2.1. Виробники: введення додаткової альтернативної дільниці, на якій здійснюється контроль якості та дослідження стабільності для АФІ Колістиметату натрію Кселія Фармасьютікелз Лтд., Угорщина |
За рецептом |
UA/7533/01/02 |
| 90. |
КОНТРАХІСТ АЛЕРДЖІ® |
таблетки, вкриті плівковою оболонкою, по 5 мг по 10 таблеток у блістері; по 1 блістеру в картонній коробці; по 7 таблеток у блістері; по 1 блістеру в картонній коробці |
АТ «Адамед Фарма» |
Польща |
виробництво, первинне та вторинне пакування:
Заклад Фармацевтичний Адамед Фарма С.А., Польща;
первинне та вторинне пакування, контроль якості та випуск серії:
Паб’яніцький фармацевтичний завод Польфа А.Т. Польща |
Польща |
внесення змін до реєстраційних матеріалів: приведення у відповідність до інструкції для медичного застосування написання умов відпуску в наказі МОЗ України № 1194 від 29.05.2019 в процесі внесення змін (
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — Зміна контактних даних уповноваженої особи заявника, відповідальної за здійснення фармаконагляду. Зміна контактних даних контактної особи, відповідальної за здійснення фармаконагляду в Україні. Заміна місця здійснення основної діяльності з фармаконагляду. Заміна місцезнаходження мастер-файла системи фармаконагляду). Редакція в наказі — за рецептом. Запропонована редакція — без рецепта. |
Без рецепта |
UA/15823/01/01 |
| 91. |
КСИПОГАМА® |
таблетки по 10 мг, по 10 таблеток у блістері; по 3 або по 5, або по 10 блістерів у картонній коробці |
Вьорваг Фарма ГмбХ і Ко.КГ |
Німеччина |
Артезан Фарма ГмбХ і Ко. КГ |
Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — введення нового виробника АФІ ксипаміду, з наданням мастер-файлу на АФІ додатково до же затвердженого виробника |
За рецептом |
UA/6557/01/01 |
| 92. |
КСИПОГАМА® |
таблетки по 20 мг, по 10 таблеток у блістері; по 3 або по 5, або по 10 блістерів у картонній коробці |
Вьорваг Фарма ГмбХ і Ко.КГ |
Німеччина |
Артезан Фарма ГмбХ і Ко. КГ |
Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — введення нового виробника АФІ ксипаміду, з наданням мастер-файлу на АФІ додатково до же затвердженого виробника |
За рецептом |
UA/6557/01/02 |
| 93. |
КСИПОГАМА® |
таблетки по 40 мг по 10 таблеток у блістері; по 3 або по 5, або по 10 блістерів у картонній коробці |
Вьорваг Фарма ГмбХ і Ко.КГ |
Німеччина |
Артезан Фарма ГмбХ і Ко. КГ |
Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — введення нового виробника АФІ ксипаміду, з наданням мастер-файлу на АФІ додатково до же затвердженого виробника |
За рецептом |
UA/6557/01/03 |
| 94. |
КУВАН® |
таблетки розчинні по 100 мг; по 30 або по 120 таблеток у поліетиленовому флаконі; по 1 флакону у картонній коробці |
БіоМарін Інтернешнл Лімітед |
Ірландiя |
виробництво нерозфасованої продукції, первинне пакування у флакони та контроль якості лікарського засобу:Екселла ГмбХ енд Ко. КГ, Німеччина;контроль якості лікарського засобу (мікробне тестування):Лабор ЛС СЕ енд Ко. КГ, НімеччинаабоСГС Інститут Фрезеніус ГмбХ, Німеччина;маркування флаконів та вторинне пакування:Міллмаунт Хелскеар Лтд, ІрландіяабоБіоМарін Інтернешнл Лімітед, Ірландiя;відповідальний за випуск серії:БіоМарін Інтернешнл Лімітед, Ірландiя |
Німеччина/Ірландія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, не включаючи випуск серій) — зміна назви виробничої дільниці для ГЛЗ Лабор ЛС СЕ енд Ко. КГ, Німеччина, відповідальної за контроль якості лікарського засобу (мікробне тестування), без зміни місця виробництва (Введення змін протягом 6 місяців після затвердження) |
За рецептом |
UA/12202/01/01 |
| 95. |
ЛАФЕРОМАКС |
супозиторії по 1 000 000 МО по 3 супозиторії по 1 г у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці в пачці з картону; по 5 супозиторіїв по 1 г у контурній чарунковій упаковці; по 1 або по 2 контурні чарункові упаковки в пачці з картону |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни внесено в інструкцію для медичного застосування лікарського засобу до розділу «Спосіб застосування та дози» |
За рецептом |
UA/13779/01/03 |
| 96. |
ЛАФЕРОМАКС |
супозиторії по 3 000 000 МО по 3 супозиторії по 1 г у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці в пачці з картону; по 5 супозиторіїв по 1 г у контурній чарунковій упаковці; по 1 або по 2 контурні чарункові упаковки в пачці з картону |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни внесено в інструкцію для медичного застосування лікарського засобу до розділу «Спосіб застосування та дози» |
За рецептом |
UA/13779/01/04 |
| 97. |
ЛЕВОФЛОКСАЦИНУ ГЕМІГІДРАТ |
порошок (субстанція) у подвійних поліетиленових мішках для фармацевтичного застосування |
Товариство з обмеженою відповідальністю «Торгова компанія «Аврора» |
Україна |
Шанюй Цзинсинь Фармасьютикал Ко, ЛТД, |
Китай |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення Специфікації на АФІ Левофлоксацину гемігідрат до вимог монографії USP на Levofloxacin, а саме, вилучення зі Специфікації АФІ показника «Важкі метали» відповідно до монографії та оригінальних матеріалів виробника |
— |
UA/10977/01/01 |
| 98. |
ЛЕНЗЕТТО® |
спрей трансдермальний, розчин, 1,53 мг/дозу;
по 8,1 мл розчину (56 доз) у скляному флаконі, який забезпечений дозуючим насосом з розпилювачем і активатором; по 1 флакону в аплікаторі з конічним купольним отвором, що закривається кришкою, яка має з внутрішньої сторони поглинаючу прокладку; по 1 аплікатору в картонній коробці |
ВАТ «Гедеон Ріхтер» |
Угорщина |
Гедеон Ріхтер Румунія А.Т. |
Румунія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи, відповідальної за здійснення фармаконагляду. Діюча редакція: Judit Szell. Пропонована редакція: Attila Olah. Зміна контактних даних уповноваженої особи, відповідальної за здійснення фармаконагляду. |
За рецептом |
UA/17185/01/01 |
| 99. |
ЛЕТЕРО |
таблетки, вкриті плівковою оболонкою, по 2,5 мг по 10 таблеток у блістері; по 1 або по 3 блістери в коробці з картону |
Гетеро Лабз Лімітед |
Індія |
Гетеро Лабз Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування генеричних/гібридних/біоподібних лікарських засобів після внесення тієї самої зміни на референтний препарат (зміна не потребує надання жодних нових додаткових даних) — зміни внесено до інструкції для медичного застосування лікарського засобу до розділів: «Фармакологічні властивості», «Показання», «Протипоказання», «Взаємодія з іншими лікарськими засобами та інші види взаємодій», «Особливості застосування», «Застосування у період вагітності або годування груддю», «Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами», «Спосіб застосування та дози», «Передозування», «Побічні реакції» відповідно до інформації референтного лікарського засобу Фемара, таблетки, вкриті плівковою оболонкою, по 2,5 мг. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/14176/01/01 |
| 100. |
ЛІВОСТОР |
таблетки, вкриті плівковою оболонкою, по 10 мг, по 10 таблеток у блістері; по 3 або по 7 блістерів у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу — внесення змін до специфікації під час виробництва готового лікарського засобу — проміжна продукція. Маса для таблетування: в розділі «Опис» вилучено визначення «однорідність», вилучення контролю якості за показником «Втрата в маса при висушуванні» (контроль проводиться на стадії Сушка грануляту), зазначення проведення контролю за показником «Однорідність вмісту діючої речовини» при валідації технологічного процесу (контроль за показником «Однорідність дозованих одиниць» проводиться на етапі нерозфасованої продукції), за показником «Кількісне визначення» одиниці розмірності переведено з грамів у міліграми, відповідно відкориговані розрахункові формули; — нерозфасована продукція: введення контролю якості за показником «Ідентифікація», актуалізовано викладення розділу «Розчинення» та «Однорідність дозованих одиниць» відповідно специфікації готового лікарського засобу, за показником «Кількісне визначення» та «Середня маса таблетки» одиниці розмірності переведено з грамів у міліграми, відповідно відкориговані розрахункові формули, в розділі «Умови зберігання» внесення редакційних правок;
Зміни І типу — зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу — зміна терміну придатності проміжної та нерозфасованої продукції |
За рецептом |
UA/6452/01/01 |
| 101. |
ЛІВОСТОР |
таблетки, вкриті плівковою оболонкою, по 20 мг, по 10 таблеток у блістері; по 3 або по 7 блістерів у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу — внесення змін до специфікації під час виробництва готового лікарського засобу — проміжна продукція. Маса для таблетування: в розділі «Опис» вилучено визначення «однорідність», внесення редакційних правок, розділ « Однорідність дозованих одиниць» замінити на розділ «Однорідність вмісту діючої речовини» та зазначення проведення контролю при валідації технологічного процесу (контроль за показником «Однорідність дозованих одиниць» проводиться на етапі нерозфасованої продукції), показником «Кількісне визначення» одиниці розмірності переведено з грамів у міліграми, відповідно відкориговані розрахункові формули. — Проміжна продукція. Таблетки-ядра: вилучення контролю якості за показником «Розчинення», «Однорідність дозованих одиниць, «Кількісне визначення» та перенесення до специфікації на Нерозфасовану продукцію — нерозфасована продукція: введення контролю якості за показником «Ідентифікація», «Розчинення», «Однорідність дозованих одиниць, «Кількісне визначення», за показником «Середня маса таблетки» одиниці розмірності переведено з грамів у міліграми, відповідно відкориговані розрахункові формули;
Зміни І типу — зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу — зміна терміну придатності проміжної та нерозфасованої продукції |
За рецептом |
UA/6452/01/02 |
| 102. |
ЛІВОСТОР |
таблетки, вкриті плівковою оболонкою, по 40 мг по 10 таблеток у блістері; по 3 блістери у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу — внесення змін до специфікації під час виробництва готового лікарського засобу — проміжна продукція. Маса для таблетування: в розділі «Опис» вилучено визначення «однорідність»; розділ « Однорідність дозованих одиниць» замінити на розділ «Однорідність вмісту діючої речовини» та зазначення проведення контролю при валідації технологічного процесу (контроль за показником «Однорідність дозованих одиниць» проводиться на етапі нерозфасованої продукції); — Проміжна продукція. Таблетки-ядра: вилучення контролю якості за показником «Розчинення», «Однорідність дозованих одиниць, «Кількісне визначення» та перенесення до специфікації на Нерозфасовану продукцію. — нерозфасована продукція: введення контролю якості за показником «Ідентифікація», «Розчинення», «Однорідність дозованих одиниць, «Кількісне визначення»;
Зміни І типу — зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу — зміна терміну придатності проміжної та нерозфасованої продукції |
За рецептом |
UA/6452/01/03 |
| 103. |
ЛЮГОЛЯ РОЗЧИН З ГЛІЦЕРИНОМ |
розчин оромукозний по 25 г у флаконах; по 25 г у флаконі, по 1 флакону в пачці з картону |
ТОВ «Тернофарм» |
Україна |
ТОВ «Тернофарм» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — введення нового виробника для АФІ Йод ORGANICA Feinchemie GmbH Wolfen, Німеччина (контроль якості, вторинне пакування, відповідальний за випуск серії в обіг), Atacama Minerals Chile S.C.M., Чилі (виробництво, контроль якості, первинне пакування) з наданням майстер-файла на АФІ |
Без рецепта |
UA/0343/01/01 |
| 104. |
МАГНІКУМ |
таблетки, вкриті плівковою оболонкою, кишковорозчинні, по 10 таблеток у блістері; по 5 блістерів у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Новий сертифікат від вже затвердженого виробника —
подання нового Сертифікату R0-CEP 2013-165-Rev 01 для АФІ Піридоксину гідрохлорид від вже затвердженого виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай, як наслідок вилучення зі специфікації АФІ контроль за показником «Важкі метали» для виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай. |
Без рецепта |
UA/7038/01/01 |
| 105. |
МЕДРОЛГІН |
розчин для ін’єкцій, 30 мг/мл по 1 мл розчину в ампулі; по 5 ампул у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці в картонній коробці |
УОРЛД МЕДИЦИН ІЛАЧ САН. ВЕ ТІДЖ. A.Ш. |
Туреччина |
ФармаВіжн Сан. ве Тідж. А.Ш. |
Туреччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи відповідальної за фармаконагляд: Діюча редакція: Хюсейн Тоніялі/Mr. Huseyin Tonyali. Пропонована редакція: Мевсім Ількбахар Дінчель/Mrs. Mevsim Ilkbahar Dincel. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна контактних даних контактної особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла |
За рецептом |
UA/14770/01/01 |
| 106. |
МЕКСИКОР® |
капсули по 100 мг, по 10 капсул у блістері; по 2 блістери в пачці з картону |
ТОВ «ЗДРАВО» |
Україна |
ПрАТ «Технолог» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення). Зміна адреси заявника ТОВ «ЗДРАВО», Україна |
За рецептом |
UA/4971/02/01 |
| 107. |
МЕТАКАРТИН |
розчин для ін’єкцій, 1 г/5 мл; по 5 мл в ампулі; по 5 ампул в контурній чарунковій упаковці; по 1 або 2 контурні чарункові упаковки в картонній коробці |
УОРЛД МЕДИЦИН ІЛАЧ САН. ВЕ ТІДЖ. А.Ш. |
Туреччина |
Мефар Ілач Сан. А.Ш. |
Туреччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Зміна уповноваженої особи відповідальної за фармаконагляд: Діюча редакція: Хюсейн Тоніялі/Mr. Huseyin Tonyali. Пропонована редакція: Мевсім Ількбахар Дінчель/Mrs. Mevsim Ilkbahar Dincel. Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна контактних даних контактної особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла. |
За рецептом |
UA/15530/01/01 |
| 108. |
МІЛДРАЛЕКС-ЗДОРОВ’Я |
розчин для ін’єкцій, 100 мг/мл по 5 мл в ампулі; по 10 ампул у коробці з картону; по 5 мл в ампулі; по 5 ампул у блістері; по 2 блістери в коробці з картону |
Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я» |
Україна |
Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ (за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє)(введення нового виробника АФІ з наданням мастер-файла на АФІ); супутня зміна: зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ (інші зміни); зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ; введення нового виробника АФІ Мельдонію дигідрат Товариство з обмеженою відповідальністю «ФАРМХІМ», з наданням мастер-файла на АФІ. Як наслідок, внесення змін до специфікації та методів вхідного контролю АФІ Мельдонію дигідрат за показником «Залишкова кількість органічних розчинників» та «рН» відповідно до вимог нормативної документації виробника |
За рецептом |
UA/11215/01/01 |
| 109. |
М-М-РВАКСПРО® ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ КОРУ, ЕПІДЕМІЧНОГО ПАРОТИТУ ТА КРАСНУХИ ЖИВА |
порошок для суспензії для ін’єкцій;
1 флакон з порошком (1 доза) та 1 флакон з розчинником (вода для ін’єкцій) по 0,7 мл у картонній коробці; 1 флакон з порошком (1 доза) та 1 попередньо наповнений шприц з розчинником (вода для ін’єкцій) по 0,7 мл в комплекті з двома голками у картонній коробці; 10 флаконів з порошком та 10 флаконів з розчинником (вода для ін’єкцій) по 0,7 мл в окремих картонних коробках. Маркування українською мовою. |
Мерк Шарп і Доум ІДЕА ГмбХ |
Швейцарія |
виробник вакцини in bulk та первинне пакування:
Мерк Шарп і Доум Корп., США
вторинне пакування, випуск серії вакцини та розчинника
Мерк Шарп і Доум Б.В., Нідерланди |
США/Нідерланди |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб (інші зміни) Додавання альтернативних флаконів для розчинника, не оброблених 3% сульфатом амонію, виробництва Ompi, Мексика і Schott, США |
За рецептом |
UA/14950/01/01 |
| 110. |
МОМЕТАЗОН-ТЕВА |
спрей назальний, суспензія, 50 мкг/доза по 10 г (60 доз) у флаконі з дозуючим спрей-насосом та розпилювачем, закритим ковпачком; по 1 флакону в картонній коробці |
Тева Фармацевтікал Індастріз Лтд. |
Ізраїль |
виробництво за повним циклом: Тева Чех Індастріз с.р.о., Чеська Республіка; контроль серії за показником «Визначення мометазону фуроату у малих краплях/частках»: Мельбурн Сайнтифік Лімітед, Велика Британiя |
Чеська Республіка/, Велика Британiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Контроль допоміжних речовин. Зміна у методах випробування допоміжної речовини (незначні зміни у затверджених методах випробувань) Незначні зміни у внутрішній методиці за показником «Розмір часток», що використовується для контролю якості допоміжної речовини «Целюлоза мікрокристалічна та натрію кармелоза». |
За рецептом |
UA/15611/01/01 |
| 111. |
МОРКВИ ДИКОЇ ПЛОДІВ І НАГІДОК КВІТІВ ЕКСТРАКТ ГУСТИЙ |
екстракт густий (субстанція) в бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції |
— |
UA/13985/01/01 |
| 112. |
МУКАЛТИН |
таблетки по 50 мг; по 30 таблеток у банці або контейнері; по 1 банці або контейнеру у пачці з картону; по 10 таблеток у контурних безчарункових упаковках; по 30 таблеток у банках або контейнерах; по 10 таблеток у блістерах; по 10 таблеток у блістері; по 1, або по 3, або по 10 блістерів в пачці з картону |
Товариство з обмеженою відповідальністю «Дослідний завод «ГНЦЛС» |
Україна |
всі стадії виробництва, контроль якості, випуск серії:Товариство з обмеженою відповідальністю «Дослідний завод « ГНЦЛС»,Україна;всі стадії виробництва, контроль якості, випуск серії:Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я»,Україна |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна розміру упаковки готового лікарського засобу (зміна кількості одиниць (наприклад таблеток, ампул тощо) в упаковці:) — Зміна поза діапазоном затверджених розмірів упаковки — введення додаткових розмірів упаковок з новим типом первинного пакування: по 10 таблеток у блістері; по 10 таблеток у блістері, по 1 блістеру у пачці з картону; по 10 таблеток у блістері, по 3 блістери у пачці з картону; по 10 таблеток у блістері, по 10 блістерів у пачці з картону (Введення змін протягом 3-х місяців після затвердження);
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна у первинній упаковці готового лікарського засобу (тип контейнера або додавання нового контейнера) — Тверді, м’які та нестерильні рідкі лікарські форми — введення додаткового типу первинного пакування — блістер з плівки полівінілхлоридної та фольги алюмінієвої від додаткових виробників: — фольга алюнімієва: ТОВ «Алтрейд», Україна; ФОП Романов С.В., Україна; ТОВ «АЛЬДЕКСА», Україна; — плівка полівінілхлоридна: HUA XIANG PLASTIC CO, LTD., Китай (Введення змін протягом 3-х місяців після затвердження)
Супутня зміна
— Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна постачальника пакувальних матеріалів або комплектуючих (якщо зазначено в досьє) (заміна або додавання постачальника);
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна постачальника пакувальних матеріалів або комплектуючих (якщо зазначено в досьє) (заміна або додавання постачальника) — введення додаткових постачальників первинного пакування, як наслідок зміна якісного та кількісного складу, форми та розміру пакувального матеріалу: — бумага, ламінована поліетиленом, для контурної безчарункової упаковки: ТОВ «АЛЬДЕКСА», Україна; — контейнер (20 мл), кришка до контейнеру (20 мл) — ТОВ «АСС — Харківпласт», Україна (Введення змін протягом 3-х місяців після затвердження)
Супутня зміна
— зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна у первинній упаковці готового лікарського засобу (якісний та кількісний склад) — Тверді лікарські форми;
— зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна форми або розміру контейнера чи закупорювального засобу (первинної упаковки) (нестерильні лікарські засоби);
— зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна параметрів специфікацій та/або допустимих меж первинної упаковки готового лікарського засобу (інші зміни) |
Без рецепта |
UA/5779/01/01 |
| 113. |
М’ЯТИ ПЕРЦЕВОЇ ЛИСТЯ |
листя по 50 г у пачках з внутрішнім пакетом; по 1,5 г у фільтр-пакеті; по 20 фільтр-пакетів у пачці |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни в текст маркування вторинної упаковки лікарського засобу (розширення інформації). Введення змін протягом 3-х місяців після затвердження |
Без рецепта |
UA/2261/01/01 |
| 114. |
НАТРІЮ ДИКЛОФЕНАК-КВ |
капсули тверді по 25 мг, по 10 капсул у блістері; по 3 блістери в пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — вилучення показника «Розчинність» (ДФУ 1.4.) зі специфікації АФІ, оскільки згідно до ДФУ* цей тест не є обов’язковою вимого;
Зміни І типу — подання нового сертифікату відповідності Європейської фармакопеї № R0-CEP 2014-009-Rev 00 від нового виробника АФІ натрію дилофенак, як наслідок, внесення уточнення до специфікації та методів контролю АФІ (Залишкові кількості органічних розчинників), упаковки та терміну придатності відповідно до заявленого СЕР;
Зміни І типу — незначні зміни у методах випробування готового лікарського засобу за показником «МБЧ», у зв’язку з оптимізацією контролю якості (зменшення кількості розчинів для пробопідготовки та кількості зразків для закладення в архів) |
За рецептом |
UA/2091/01/01 |
| 115. |
НАТРІЮ ДИКЛОФЕНАК-КВ |
капсули тверді по 25 мг, по 10 капсул у блістері; по 3 блістери в пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ (інші зміни); супутня зміна: зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ (незначні зміни у затверджених методах випробування) |
За рецептом |
UA/2091/01/01 |
| 116. |
НІФУРОКСАЗИД |
таблетки, вкриті оболонкою, по 0,1 г № 10, № 30 (10х3) у блістері |
ТОВ «Тернофарм» |
Україна |
ТОВ «Тернофарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування готового лікарського засобу (незначна зміна у затверджених методах випробування) |
За рецептом |
UA/14644/01/01 |
| 117. |
НОВОКС® |
розчин для інфузій 0,5% по 100 мл або 150 мл у пляшці; по 1 пляшці у пачці |
ОРГАНОСИН ЛАЙФСАЄНСИЗ (ЕФ ЗЕТ СІ) |
Об’єднанi Арабськi Емiрати |
Приватне акціонерне товариство «Інфузія» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміна у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування на підставі регулярно оновлюваного звіту з безпеки лікарського засобу, або досліджень з безпеки застосування лікарського засобу в післяреєстраційний період, або як результат оцінки звіту з досліджень, проведених відповідно до плану педіатричних досліджень (РІР) (зміну узгоджено з компетентним уповноваженим органом) — зміни внесено до інструкції для медичного застосування лікарського засобу у розділи: «Показання» (інформація з безпеки), «Особливості застосування», «Спосіб застосування та дози» (інформація з безпеки), «Побічні реакції» відповідно до оновленої інформації з безпеки діючої речовини (Введення змін протягом 3-х місяців після затвердження) |
За рецептом |
UA/16886/01/01 |
| 118. |
НОВО-ПАСИТ |
розчин оральний, по 100 мл у флаконі; по 1 флакону з мірним ковпачком в коробці; по 5 мл у саше; по 30 саше в коробці |
Тева Фармацевтікал Індастріз Лтд. |
Ізраїль |
Тева Чех Індастріз с.р.о. |
Чеська Республiка |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) Діюча редакція: Уповноважена особа заявника, відповідальна за фармаконагляд — Dr. Hedva Voliovitch MD, PhD. Пропонована редакція: Уповноважена особа заявника, відповідальна за фармаконагляд — Orit Stern-Maman. Контактна особа заявника, відповідальна за фармаконагляд — Бистрова Оксана Віталіївна.
Зміна контактних даних уповноваженої особи, відповідальної за фармаконагляд. Зміна контактних даних контактної особи, відповідальної за фармаконагляд. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна місцезнаходження мастер-файла. |
Без рецепта |
UA/9976/01/01 |
| 119. |
НОРМОПРЕС |
таблетки по 10 таблеток у блістері; по 2 блістери у пачці; по 10 таблеток у блістерах |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) — збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі: Затверджено: Термін придатності. 2 роки Запропоновано: Термін придатності. 3 роки (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/3668/01/01 |
| 120. |
ОКСОЛІНОВА МАЗЬ |
мазь, 2,5 мг/г по 10 г у тубі; по 1 тубі в пачці з картону |
ТОВ «Тернофарм» |
Україна |
ТОВ «Тернофарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — введення РСЗ субстанції оксоліну в методах контролю на готовий лікарський засіб та проміжний продукт(кількісне визначення) |
Без рецепта |
UA/14265/01/01 |
| 121. |
ОНБРЕЗ БРИЗХАЙЛЕР |
порошок для інгаляцій, тверді капсули по 150 мкг № 10 (10х1), № 30 (10х3) у блістерах з 1 інгалятором |
Новартіс Фарма АГ |
Швейцарія |
виробництво за повним циклом:
Новартіс Фарма Штейн А, Швейцарія
контроль якості (за винятком тесту мікробіологічна чистота):
Фарманалітика СА, Швейцарія
контроль якості за показниками: «Опис вмісту», «Оболонка»; первинне та вторинне пакування, випуск серії:
Новартіс Фармасьютика С.А., Іспанія
первинне та вторинне пакування:
Конафарма АГ, Швейцарія |
Швейцарія/ Іспанія |
внесення змін до реєстраційних матеріалів:зміни II типу — зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ (за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє)(введення нового виробника АФІ, коли не подається мастер-файл на АФІ та що вимагає значної зміни до відповідного розділу досьє на АФІ) |
За рецептом |
UA/11706/01/01 |
| 122. |
ОНБРЕЗ БРИЗХАЙЛЕР |
порошок для інгаляцій, тверді капсули по 300 мкг № 10 (10х1), № 30 (10х3) у блістерах з 1 інгалятором |
Новартіс Фарма АГ |
Швейцарія |
виробництво за повним циклом:
Новартіс Фарма Штейн А, Швейцарія
контроль якості (за винятком тесту мікробіологічна чистота):
Фарманалітика СА, Швейцарія
контроль якості за показниками: «Опис вмісту», «Оболонка»; первинне та вторинне пакування, випуск серії:
Новартіс Фармасьютика С.А., Іспанія
первинне та вторинне пакування:
Конафарма АГ, Швейцарія |
Швейцарія/ Іспанія |
внесення змін до реєстраційних матеріалів:зміни II типу — зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ (за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє)(введення нового виробника АФІ, коли не подається мастер-файл на АФІ та що вимагає значної зміни до відповідного розділу досьє на АФІ) |
За рецептом |
UA/11706/01/02 |
| 123. |
ОНБРЕЗ БРИЗХАЙЛЕР |
порошок для інгаляцій, тверді капсули по 150 мкг № 10 (10х1), № 30 (10х3) у блістерах з 1 інгалятором |
Новартіс Фарма АГ |
Швейцарія |
виробництво за повним циклом:
Новартіс Фарма Штейн А, Швейцарія
контроль якості (за винятком тесту мікробіологічна чистота):
Фарманалітика СА, Швейцарія
контроль якості за показниками: «Опис вмісту», «Оболонка»; первинне та вторинне пакування, випуск серії:
Новартіс Фармасьютика С.А., Іспанія
первинне та вторинне пакування:
Конафарма АГ, Швейцарія |
Швейцарія/ Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна параметрів специфікацій та/або допустимих меж для допоміжної речовини — звуження допустимих меж для допоміжної речовини (лактоза моногідрат) показника «Amorphous lactose»; звуження допустимих меж для допоміжної речовини (лактоза моногідрат) показника Розмір часток (метод лазерної дифракції); звуження допустимих меж для допоміжної речовини (лактоза моногідрат) — за показником «Кількість білку (у вигляді нітрогену»); доповнення специфікації новим показником з відповідним методом випробування для допоміжної речовини (лактози моногідрат) до тесту Супутні домішки;
Зміни І типу — зміна у методах випробування допоміжної речовини — незначні зміни у затверджених методах випробувань для допоміжної речовини (лактози моногідрат) визначення вмісту білку (методом Кельдаля) — оптимізація методу випробувань; незначні зміни у затверджених методах випробувань для допоміжної речовини (лактози моногідрат) т «Супутні Домішки»- оптимізація методу випробувань;
Зміни І типу — зміни, пов’язані з необхідністю приведення у відповідність до монографії ДФУ або Європейської фармакопеї, або іншої національної фармакопеї держави ЄС — приведення специфікації допоміжної речовини (лактози моногідрат) до вимог монографії ЕР |
За рецептом |
UA/11706/01/01 |
| 124. |
ОНБРЕЗ БРИЗХАЙЛЕР |
порошок для інгаляцій, тверді капсули по 300 мкг № 10 (10х1), № 30 (10х3) у блістерах з 1 інгалятором |
Новартіс Фарма АГ |
Швейцарія |
виробництво за повним циклом:
Новартіс Фарма Штейн А, Швейцарія
контроль якості (за винятком тесту мікробіологічна чистота):
Фарманалітика СА, Швейцарія
контроль якості за показниками: «Опис вмісту», «Оболонка»; первинне та вторинне пакування, випуск серії:
Новартіс Фармасьютика С.А., Іспанія
первинне та вторинне пакування:
Конафарма АГ, Швейцарія |
Швейцарія/ Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна параметрів специфікацій та/або допустимих меж для допоміжної речовини — звуження допустимих меж для допоміжної речовини (лактоза моногідрат) показника «Amorphous lactose»; звуження допустимих меж для допоміжної речовини (лактоза моногідрат) показника Розмір часток (метод лазерної дифракції); звуження допустимих меж для допоміжної речовини (лактоза моногідрат) — за показником «Кількість білку (у вигляді нітрогену»); доповнення специфікації новим показником з відповідним методом випробування для допоміжної речовини (лактози моногідрат) до тесту Супутні домішки;
Зміни І типу — зміна у методах випробування допоміжної речовини — незначні зміни у затверджених методах випробувань для допоміжної речовини (лактози моногідрат) визначення вмісту білку (методом Кельдаля) — оптимізація методу випробувань; незначні зміни у затверджених методах випробувань для допоміжної речовини (лактози моногідрат) т «Супутні Домішки»- оптимізація методу випробувань;
Зміни І типу — зміни, пов’язані з необхідністю приведення у відповідність до монографії ДФУ або Європейської фармакопеї, або іншої національної фармакопеї держави ЄС — приведення специфікації допоміжної речовини (лактози моногідрат) до вимог монографії ЕР |
За рецептом |
UA/11706/01/02 |
| 125. |
ОФЕВ® |
капсули м’які по 100 мг, по 10 капсул у блістері, по 6 блістерів у картонній упаковці |
Берінгер Інгельхайм Інтернешнл ГмбХ |
Німеччина |
Первинне (блістери) та вторинне пакування, маркування, контроль якості, контроль якості за показником мікробіологічна чистота та випуск серій лікарського засобу:Берінгер Інгельхайм Фарма ГмбХ і Ко.КГ, Німеччина;Виробництво, упаковка та контроль якості (за виключенням мікробіологічної чистоти) капсул bulk (не розфасованої продукції):Каталент Німеччина Ебербах ГмбХ, Німеччина;Альтернативні дільниці для вторинного пакування та маркування:Штегеманн Льонферпакунген унд Логістішер Сервіс е. К., Німеччина;ФармЛог Фарма Лоджістік ГмбХ, Німеччина;Альтернативні лабораторії для проведення контролю якості (за виключенням Мікробіологічної чистоти):А енд Ем Штабтест ГмбХ, Німеччина;Нувісан ГмбХ, Німеччина;Альтернативна лабораторія для проведення контролю якості Мікробіологічної чистоти:СГС Інститут Фрезеніус ГмбХ, Німеччина;Лабор Л+С АГ, Німеччина |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна назви лікарського засобу — Затверджено: ОФЕВ Запропоновано: ОФЕВ® (Введення змін протягом 6 місяців після затвердження) |
За рецептом |
UA/16115/01/01 |
| 126. |
ОФЕВ® |
капсули м’які по 150 мг, по 10 капсул у блістері, по 6 блістерів у картонній упаковці |
Берінгер Інгельхайм Інтернешнл ГмбХ |
Німеччина |
Первинне (блістери) та вторинне пакування, маркування, контроль якості, контроль якості за показником мікробіологічна чистота та випуск серій лікарського засобу:Берінгер Інгельхайм Фарма ГмбХ і Ко.КГ, Німеччина;Виробництво, упаковка та контроль якості (за виключенням мікробіологічної чистоти) капсул bulk (не розфасованої продукції):Каталент Німеччина Ебербах ГмбХ, Німеччина;Альтернативні дільниці для вторинного пакування та маркування:Штегеманн Льонферпакунген унд Логістішер Сервіс е. К., Німеччина;ФармЛог Фарма Лоджістік ГмбХ, Німеччина;Альтернативні лабораторії для проведення контролю якості (за виключенням Мікробіологічної чистоти):А енд Ем Штабтест ГмбХ, Німеччина;Нувісан ГмбХ, Німеччина;Альтернативна лабораторія для проведення контролю якості Мікробіологічної чистоти:СГС Інститут Фрезеніус ГмбХ, Німеччина;Лабор Л+С АГ, Німеччина |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна назви лікарського засобу — Затверджено: ОФЕВ Запропоновано: ОФЕВ® (Введення змін протягом 6 місяців після затвердження) |
За рецептом |
UA/16115/01/02 |
| 127. |
ОФОР® |
таблетки, вкриті плівковою оболонкою, по 10 таблеток у блістері, по 1 блістеру в картонній пачці |
Органосин Лайф Саєнсиз Пвт. Лтд. |
Індія |
Евертоджен Лайф Саєнсиз Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу; зміни у процесі виробництва готового лікарського засобу у зв’язку з оптимізацією процесу на стадії грануляції, висушуванні вологих гранул, подрібнення, перемішування, пресування, покриття таблеток плівковою оболонкою; зміни II типу — зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ — введення нового виробника АФІ (орнідазолу) |
За рецептом |
UA/7732/01/01 |
| 128. |
ОФОР® |
таблетки, вкриті плівковою оболонкою, in bulk: по 2500 таблеток у пакеті, по 1 пакету у коробці із гофрокартону |
Органосин Лайф Саєнсиз Пвт. Лтд. |
Індія |
Евертоджен Лайф Саєнсиз Лімітед |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу; зміни у процесі виробництва готового лікарського засобу у зв’язку з оптимізацією процесу на стадії грануляції, висушуванні вологих гранул, подрібнення, перемішування, пресування, покриття таблеток плівковою оболонкою; зміни II типу — зміна виробника вихідного/проміжного продукту/реагенту, що використовуються у виробничому процесі АФІ, або зміна виробника (включаючи, де необхідно, місце проведення контролю якості) АФІ — введення нового виробника АФІ (орнідазолу) |
— |
UA/7733/01/01 |
| 129. |
ПЕНТАКСИМ® ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ДИФТЕРІЇ, ПРАВЦЯ, КАШЛЮКУ (АЦЕЛЮЛЯРНИЙ КОМПОНЕНТ), ПОЛІОМІЄЛІТУ ІНАКТИВОВАНА ТА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ІНФЕКЦІЙ, СПРИЧИНЕНИХ HAEMOPHILUS ТИПУ B КОН’ЮГОВАНА, АДСОРБОВАНА |
порошок Haemophilus influenzae типу b та суспензія для ін’єкцій (0,5 мл), по 1 флакону з порошком та 1 попередньо заповненому шприцу (0,5 мл) з прикріпленою голкою (або 2 окремими голками), що містить суспензію для ін’єкцій, в картонній коробці або в стандартно-експортній упаковці, яка міститься у картонній коробці |
Санофі Пастер |
Францiя |
Санофі Пастер, Францiя; САНОФІ С.П.А., Італiя; Санофі-Авентіс Прайвіт Ко. Лтд.Угорщина |
Францiя/Угорщина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ — внесення аналітичних змін до методу Molecular size distribution, який виконується при випуску АФІ (полісахарид Haemophilus influenzae типу b, кон’югований з правцевим протеїном) та при випробуванні стабільності; незначні зміни у методі випробування Polysaccharide/Protein ratio test; незначні зміни у методі Free polysaccharide content test; незначні зміни до методу Free tetanus content test; незначні зміни до методу Phosphorus content test; незначні зміни до методу визначення Residual EDAC (Ethyl-dimethyaminopropyl carbodiimide) and EDU (Ethyl-dimethyaminopropyl urea) limit test; незначні зміни до методу визначення Residual Phenol limit test; незначні зміни до методу Sucrose content test; зміни II типу — зміна у параметрах специфікацій та/або допустимих меж, визначених у специфікаціях на АФІ, або вихідний/проміжний продукт/реагент, що використовуються у процесі виробництва АФІ — видалення коефіцієнту розподілу КD з методу випробування Molecular size distribution test, яке виконується при випуску та під час випробувань стабільності для активної субстанції PRP-T (полісахарид Haemophilus influenzae типу b, кон’югований з правцевим протеїном) |
За рецептом |
UA/13010/01/01 |
| 130. |
ПОЛИНУ ГІРКОГО ТРАВА |
трава по 50 г у пачках з внутрішнім пакетом |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни в текст маркування вторинної упаковки лікарського засобу (розширення інформації). Ведення змін протягом 3-х місяців після затвердження |
Без рецепта |
UA/2264/01/01 |
| 131. |
ПРЕВЕНАР® 13/PREVENAR® 13 ВАКЦИНА ПНЕВМОКОКОВА ПОЛІСАХАРИДНА КОН’ЮГОВАНА (ТРИНАДЦЯТИВАЛЕНТНА АДСОРБОВАНА) |
Суспензія для ін’єкцій по 1 дозі (0,5 мл)
По 1 дозі (0,5 мл) у попередньо наповненому шприці; по 1 попередньо наповненому шприцу та одній відокремленій голці в індивідуальному чохлі у закритому пластиковому контейнері; по 1 пластиковому контейнеру у картонній коробці з маркуванням українською та англійською мовами |
Пфайзер Ейч.Сі.Пі. Корпорейшн |
США |
Ваєт Фармасеутикалс, Велика Британія
Пфайзер Менюфекчуринг Бельгія НВ, Бельгія
Пфайзер Ірленд Фармасеутикалс, Ірландія
Бакстер Фармасеутикал Солюшинс ЛЛС, США |
Велика Британія/Бельгія/Ірландія/
США |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) Вилучення дільниці Molecular Epidemiology (15300 Bothell Way NE, Lake Forest Park, WA 98155, United States) як альтернативної лабораторії для випробовування стерильності CRM197-кон’югатів пневмококових полісахаридів. |
За рецептом |
UA/15864/01/01 |
| 132. |
ПРЕГНІЛ® |
порошок для розчину для ін’єкцій по 1500 МО; 3 флакони з порошком та 3 флакони з 1 мл розчинника (розчин натрію хлориду 0,9%) в картонній упаковці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво за повним циклом (порошок для розчину для ін’єкцій), вторинне пакування та випуск серії (розчинник (розчин натрію хлориду 0,9%):Н.В. Органон, Нідерланди;Виробництво, контроль якості та випуск серії, пакування (розчинник in bulk (розчин натрію хлориду 0,9%):Джубілант XoллicтepCтаєp ЛЛC, США |
Нідерланди/США |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) Уточнення адреси заявника (власника реєстраційного посвідчення) |
За рецептом |
UA/3483/01/01 |
| 133. |
ПРЕГНІЛ® |
порошок для розчину для ін’єкцій по 5000 МО; 1 флакон з порошком та 1 флакон з 1 мл розчинника (розчин натрію хлориду 0,9%) в картонній упаковці |
Шерінг-Плау Сентрал Іст АГ |
Швейцарія |
Виробництво за повним циклом (порошок для розчину для ін’єкцій), вторинне пакування та випуск серії (розчинник (розчин натрію хлориду 0,9%):Н.В. Органон, Нідерланди;Виробництво, контроль якості та випуск серії, пакування (розчинник in bulk (розчин натрію хлориду 0,9%):Джубілант XoллicтepCтаєp ЛЛC, США |
Нідерланди/США |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення) Уточнення адреси заявника (власника реєстраційного посвідчення) |
За рецептом |
UA/3483/01/02 |
| 134. |
ПРЕФЕМІН |
таблетки, вкриті плівковою оболонкою, по 20 мг, по 30 таблеток у блістері; по 1 або по 3 блістери в картонній коробці |
Амакса Фарма ЛТД |
Велика Британiя |
виробництво, пакування, контроль якості та випуск серій: Макс Целлєр Зьоне АГ, Швейцарія; контроль якості: Лабор Цоллінгер АГ, Швейцарія; первинне та вторинне пакування, маркування: Гінсана СА, Швейцарiя; контроль серій: Інтерлабор Белп АГ, Швейца |
Швейцарія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — внесення редакційних правок до затвердженого тексту маркування на вторинній упаковці: додавання інформації щодо застосування (згідно затвердженої інструкції до лікарського засобу). Введення змін протягом 6-ти місяців після затвердження |
Без рецепта |
UA/14671/01/01 |
| 135. |
ПРИЧЕПИ ТРАВА |
трава по 50 г у пачках з внутрішнім пакетом; по 1,5 г у фільтр-пакеті; по 20 пакетів у пачці |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни в текст маркування вторинної упаковки лікарського засобу (розширення інформації). Введення змін протягом 3-х місяців після затвердження |
Без рецепта |
UA/2265/01/01 |
| 136. |
ПРОВІРОН® |
таблетки по 25 мг по 20 таблеток у блістері; по 1 блістеру у картонній пачці |
Байєр АГ |
Німеччина |
Байєр Ваймар ГмбХ і Ко. КГ |
Німеччина |
внесення змін до реєстраційних матеріалів: зміни I типу: Зміни з якості. Готовий лікарський засіб. Система контейнер/ закупорювальний засіб. Зміна форми або розміру контейнера чи закупорювального засобу (первинної упаковки) (нестерильні лікарські засоби) — зміна розмірів блістера, без зміни первинного пакувального матеріалу (затверджено: розмір блістера (ширина х довжина 31 х 75 мм; запропоновано: розмін блістера (ширина х довжина 39 х 105 мм)). Введення змін протягом 4-х місяців після затвердження. Зміни I типу: Зміни з якості. Готовий лікарський засіб. Система контейнер /закупорювальний засіб. Зміна розміру упаковки готового лікарського засобу (зміна кількості одиниць (наприклад таблеток, ампул тощо) в упаковці. Зміна у діапазоні затверджених розмірів упаковки — зміна кількості таблеток у блістері та кількості блістерів у пачці, без зміни первинного пакувального матеріалу, з відповідними змінами у р. «Упаковка». Затверджено: «по 10 таблеток у блістері; по 2 блістери у картонній пачці». Запропоновано: «по 20 таблеток у блістері; по 1 блістеру у картонній пачці»
Зміни внесено в інструкцію для медичного застосування лікарського засобу у р. «Упаковка». Введення змін протягом 4-х місяців після затвердження. |
За рецептом |
UA/3058/01/01 |
| 137. |
ПРОВІРОН® |
таблетки по 25 мг, по 20 таблеток у блістері; по 1 блістеру у картонній пачці |
Байєр Фарма АГ |
Німеччина |
Байєр Ваймар ГмбХ і Ко. КГ |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу (вилучення несуттєвого випробування в процесі виробництва) на стадії 2.2.Пресування таблеток вилучено додаткові тестування на масу, товщину та стійкість на стискання, які проводились кожні 30 хвилин. А також у розділ 3.2.Р.3.3.Опис виробничого процесу та контролю процесу внесено редакційні правки.
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Опис та склад. Зміна у складі (допоміжних речовинах) готового лікарського засобу (інші допоміжні речовини) — Будь-яка незначна зміна кількісного складу допоміжних речовин у готовому лікарському засобі — внесено уточнення до розділу 3.2.Р.1.Опис і склад лікарського засобу стосовно кількісного складу допоміжних речовин магнію стеарату та лактози моногідрату. А також у розділі 3.2.Р.3.2.Склад на серію внесено редакційні правки (чітко розписано склад діючих та допоміжних речовин на затверджені розміри серій). |
За рецептом |
UA/3058/01/01 |
| 138. |
ПРОСТАЛАД |
настойка для перорального застосування по 100 мл у флаконі або у банці із скломаси; по 1 флакону або банці в пачці з картону; по 100 мл у флаконі або у банці полімерній; по 1 флакону або банці в пачці з картону |
ТОВ «Українська фармацевтична компанія» |
Україна |
ПрАТ «Біолік» |
Україна |
внесення змін до реєстраційних матеріалів: уточнення статусу рекламування лікарського засобу в наказі МОЗ України № 1396 від 13.06.2019 в процесі перереєстрації. Редакція в наказі — дозволено. Запропонована редакція — заборонено. |
Без рецепта |
UA/1194/01/01 |
| 139. |
РЕДДИТУКС |
концентрат для розчину для інфузій, 10 мг/мл, по 10 мл (100 мг) або 50 мл (500 мг) у флаконі; по 1 флакону в картонній коробці; по 1 картонній коробці у пластиковому мішку |
Д-р Редді’с Лабораторіс Лтд |
Індія |
Д-р Редді’с Лабораторіс Лтд |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна адреси виробника ГЛЗ Д-р Редді’с Лабораторіс Лтд, Індія, без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/12905/01/01 |
| 140. |
РЕДДИТУКС |
концентрат для розчину для інфузій, 10 мг/мл, in bulk: по 10 мл (100 мг) або 50 мл (500 мг) у флаконі; по 1000 флаконів у коробці |
Д-р Редді’с Лабораторіс Лтд |
Індія |
Д-р Редді’с Лабораторіс Лтд |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна адреси виробника ГЛЗ Д-р Редді’с Лабораторіс Лтд, Індія, без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження) |
— |
UA/12906/01/01 |
| 141. |
РЕММАКС-КВ |
таблетки жувальні з м’ятним смаком; по 6 таблеток у блістері; по 3 блістери у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) Збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: Термін придатності. 2 роки Запропоновано: Термін придатності. 3 роки Введення змін протягом 6-ти місяців після затвердження. |
Без рецепта |
UA/11362/01/01 |
| 142. |
РЕММАКС-КВ |
таблетки жувальні з апельсиновим смаком; по 6 таблеток у блістері; по 3 блістери у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) Збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: Термін придатності. 2 роки Запропоновано: Термін придатності. 3 роки Введення змін протягом 6-ти місяців після затвердження. |
Без рецепта |
UA/12125/01/01 |
| 143. |
РЕММАКС-КВ |
таблетки жувальні з малиновим смаком; по 6 таблеток у блістері; по 3 блістери у пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) Збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: Термін придатності. 2 роки Запропоновано: Термін придатності. 3 роки Введення змін протягом 6-ти місяців після затвердження. |
Без рецепта |
UA/12126/01/01 |
| 144. |
РЕФАКТО АФ (БУЛО: РЕФАКТО AF) |
ліофілізат для розчину для ін’єкцій по 250 МО; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво ліофілізату за повним циклом; контроль якості розчинника (окрім дослідження сили тертя поршня), пакування розчинника у набір; відповідальний за випуск серії:
Ваєт Фарма С.А., Іспанiя
альтернативна лабораторія для тестування препарату за показником стерильність:
Лабораторія Біолаб, С.Л., Іспанiя
виробництво розчинника в шприцах та контроль якості (окрім дослідження герметичності, сили тертя поршня), візуальний контроль розчинника:
Веттер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня)):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ Німеччина |
Іспанiя/Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Особливості застосування», «Побічні реакції»(клінічні дослідження випадків утворення інгібіторів фактора VIII); зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Спосіб застосування та дози», «Побічні реакції» (клінічні дослідження застосування у попередньо лікованих дітей віком до <12 років). Введення змін протягом 3 місяців після затвердження |
За рецептом |
UA/15929/01/01 |
| 145. |
РЕФАКТО АФ (БУЛО: РЕФАКТО AF) |
ліофілізат для розчину для ін’єкцій по 500 МО; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво ліофілізату за повним циклом; контроль якості розчинника (окрім дослідження сили тертя поршня), пакування розчинника у набір; відповідальний за випуск серії:
Ваєт Фарма С.А., Іспанiя
альтернативна лабораторія для тестування препарату за показником стерильність:
Лабораторія Біолаб, С.Л., Іспанiя
виробництво розчинника в шприцах та контроль якості (окрім дослідження герметичності, сили тертя поршня), візуальний контроль розчинника:
Веттер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня)
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня)):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина |
Іспанiя/Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Особливості застосування», «Побічні реакції»(клінічні дослідження випадків утворення інгібіторів фактора VIII); зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Спосіб застосування та дози», «Побічні реакції» (клінічні дослідження застосування у попередньо лікованих дітей віком до <12 років). Введення змін протягом 3 місяців після затвердження |
За рецептом |
UA/15929/01/02 |
| 146. |
РЕФАКТО АФ (БУЛО: РЕФАКТО AF) |
ліофілізат для розчину для ін’єкцій по 1000 МО; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво ліофілізату за повним циклом; контроль якості розчинника (окрім дослідження сили тертя поршня), пакування розчинника у набір; відповідальний за випуск серії:
Ваєт Фарма С.А., Іспанiя
альтернативна лабораторія для тестування препарату за показником стерильність:
Лабораторія Біолаб, С.Л., Іспанiя
виробництво розчинника в шприцах та контроль якості (окрім дослідження герметичності, сили тертя поршня), візуальний контроль розчинника:
Веттер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня)):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина |
Іспанiя/Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Особливості застосування», «Побічні реакції»(клінічні дослідження випадків утворення інгібіторів фактора VIII); зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Спосіб застосування та дози», «Побічні реакції» (клінічні дослідження застосування у попередньо лікованих дітей віком до <12 років). Введення змін протягом 3 місяців після затвердження |
За рецептом |
UA/15929/01/03 |
| 147. |
РЕФАКТО АФ (БУЛО: РЕФАКТО AF) |
ліофілізат для розчину для ін’єкцій по 2000 МО; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл (натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці; 1 флакон з ліофілізатом у комплекті з 1 попередньо наповненим шприцом з розчинником по 4 мл(натрію хлорид (9 мг/мл), вода для ін’єкцій), 1 адаптером для флакону, 1 системою для інфузії, 2 тампонами зі спиртом, 1 пластирем та 1 марлевою подушечкою в картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво ліофілізату за повним циклом; контроль якості розчинника (окрім дослідження сили тертя поршня), пакування розчинника у набір; відповідальний за випуск серії:
Ваєт Фарма С.А., Іспанiя
альтернативна лабораторія для тестування препарату за показником стерильність:
Лабораторія Біолаб, С.Л., Іспанiявиробництво розчинника в шприцах та контроль якості (окрім дослідження герметичності, сили тертя поршня), візуальний контроль розчинника:
Веттер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина
візуальний контроль розчинника, контроль якості розчинника (окрім дослідження герметичності, сили тертя поршня)):
Ветер Фарма-Фертигунг ГмбХ & Ко. КГ, Німеччина |
Іспанiя/Німеччина |
внесення змін до реєстраційних матеріалів:зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Особливості застосування», «Побічні реакції»(клінічні дослідження випадків утворення інгібіторів фактора VIII); зміни II типу — зміни до інструкції для медичного застосування лікарського засобу до розділів «Фармакологічні властивості», «Спосіб застосування та дози», «Побічні реакції» (клінічні дослідження застосування у попередньо лікованих дітей віком до <12 років). Введення змін протягом 3 місяців після затвердження |
За рецептом |
UA/15929/01/04 |
| 148. |
РИНТ НАЗАЛЬНИЙ СПРЕЙ® З МЕНТОЛОМ |
спрей назальний, 0,5 мг/мл, по 10 мл у флаконі разом із насосом-дозатором з розпилювачем; по 1 флакону в пачці з картону |
ПАТ «Фармак» |
Україна |
ПАТ «Фармак» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (збільшення до 10 разів порівняно із затвердженим розміром) введення додаткових розмірів серії готового лікарського засобу |
Без рецепта |
UA/12119/01/01 |
| 149. |
РИНТ НАЗАЛЬНИЙ СПРЕЙ® ЗВОЛОЖУЮЧИЙ |
спрей назальний, 0,5 мг/мл, по 10 мл у флаконі разом з насосом-дозатором з розпилювачем; по 1 флакону в пачці з картону |
ПАТ «Фармак» |
Україна |
ПАТ «Фармак» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (збільшення до 10 разів порівняно із затвердженим розміром) введення додаткових розмірів серії готового лікарського засобу. |
Без рецепта |
UA/12120/01/01 |
| 150. |
РОТАРИКС![™]() /ROTARIX /ROTARIX![™]() ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ РОТАВІРУСНОЇ ІНФЕКЦІЇ ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ РОТАВІРУСНОЇ ІНФЕКЦІЇ |
суспензія оральна (1,5 мл/дозу), по 1 або по 5 попередньо заповнених оральних аплікаторів або туб в картонній коробці з маркуванням українською мовою, або в коробці зі стикером українською мовою |
ГлаксоСмітКляйн Експорт Лімітед |
Велика Британiя |
ГлаксоСмітКляйн Біолоджікалз С.А. |
Бельгія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміни випробувань або допустимих меж, встановлених у специфікаціях, під час виробництва готового лікарського засобу (звуження допустимих меж) Звуження допустимих меж для значення рН для адипінату/цукрози буферного розчину з 6,3-7,3 до 6,3-7,0 в процесі виробництва готового продукту HRV vaccine. |
За рецептом |
UA/13060/01/01 |
| 151. |
САЛІЦИЛОВА МАЗЬ |
мазь 2% по 25 г у контейнерах; по 20 г у тубах; по 20 г у тубі; по 1 тубі у пачці; по 25 г у тубах; по 25 г у тубі; по 1 тубі у пачці |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — введення додаткового виробника для АФІ Саліцилової кислоти з наданням DMF на АФІ |
Без рецепта |
UA/6683/01/01 |
| 152. |
САЛІЦИЛОВА МАЗЬ |
мазь 5% по 25 г у контейнерах; по 20 г у тубах; по 20 г у тубі; по 1 тубі у пачці; по 25 г у тубах; по 25 г у тубі; по 1 тубі у пачці |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — введення додаткового виробника для АФІ Саліцилової кислоти з наданням DMF на АФІ |
Без рецепта |
UA/6683/01/02 |
| 153. |
САЛІЦИЛОВА МАЗЬ |
мазь 10%, по 25 г у контейнерах; по 20 г у тубах; по 20 г у тубі; по 1 тубі у пачці; по 25 г у тубах; по 25 г у тубі; по 1 тубі у пачці |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:зміни II типу — введення додаткового виробника для АФІ Саліцилової кислоти з наданням DMF на АФІ |
Без рецепта |
UA/6683/01/03 |
| 154. |
СЕПТЕФРИЛ®-ДАРНИЦЯ |
таблетки по 0,2 мг; по 10 таблеток у контурній чарунковій упаковці, по 1 або по 2, або по 4 контурні чарункові упаковки в пачці; по 10 таблеток у контурних чарункових упаковках |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна розміру упаковки готового лікарського засобу (зміна кількості одиниць (наприклад таблеток, ампул тощо) в упаковці:) — Зміна поза діапазоном затверджених розмірів упаковки — додавання нового розміру упаковки: по 10 таблеток у контурній чарунковій упаковці, по 4 контурні чарункові упаковці у пачці, без зміни первинного пакувального матеріалу, з відповідними змінами у розділі «Упаковка» (Введення змін протягом 6-ти місяців після затвердження) |
Без рецепта |
UA/6210/01/01 |
| 155. |
СОДЕРМ |
розчин нашкірний 0,1% по 15 мл, 30 мл, 50 мл, 100 мл у флаконах з крапельницею; по 1 флакону в картонній пачці |
Дермафарм АГ |
Німеччина |
мібе ГмбХ Арцнайміттель |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого Сертифікату відповідності Європейській фармакопеї R1-CEP 2003-095-Rev 03 від вже затвердженого виробника Teva Pharmaceutical Industries LTD, India для АФІ бетаметазону валерату |
За рецептом |
UA/10254/01/01 |
| 156. |
СОЛУ-КОРТЕФ |
порошок для розчину для ін’єкцій по 100 мг, 1 флакон з порошком у картонній коробці; 25 флаконів з порошком у піддоні для транспортування (без вторинної упаковки) |
ПФАЙЗЕР ІНК. |
США |
Пфайзер Менюфекчуринг Бельгія НВ |
Бельгiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна найменування та/або адреси місця провадження діяльності виробника (включаючи, за необхідності, місце проведення контролю якості), або власника мастер-файла на АФІ, або постачальника АФІ/вихідного матеріалу/реагенту/проміжного продукту, що застосовуються у виробництві АФІ — зміна назви та адреси виробника АФІ (Гідрокортизону у вигляді натрію гідрокортизону сукцинату), без зміни місця виробництва |
За рецептом |
UA/9873/01/01 |
| 157. |
СОЛУ-КОРТЕФ |
порошок та розчинник для розчину для ін’єкцій по 100 мг/2 мл; порошок та 2 мл розчинника (спирт бензиловий (9 мг/мл), вода для ін’єкцій) у флаконі типу Act-O-Vial у картонній коробці |
ПФАЙЗЕР ІНК. |
США |
Пфайзер Менюфекчуринг Бельгія НВ |
Бельгiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна найменування та/або адреси місця провадження діяльності виробника (включаючи, за необхідності, місце проведення контролю якості), або власника мастер-файла на АФІ, або постачальника АФІ/вихідного матеріалу/реагенту/проміжного продукту, що застосовуються у виробництві АФІ — зміна назви та адреси виробника АФІ (Гідрокортизону у вигляді натрію гідрокортизону сукцинату), без зміни місця виробництва |
За рецептом |
UA/9891/01/01 |
| 158. |
СПАЗМАЛГОН® |
таблетки, по 10 таблеток у блістері; по 1 або по 2, або по 5 блістерів у картонній коробці; по 20 таблеток у блістері; по 1 блістеру в картонній коробці |
Балканфарма-Дупниця АТ |
Болгарія |
Балканфарма-Дупниця АТ, Болгарія; АТ «Фармацевтична і Хімічна Індустрія, Здравлє», Сербія |
Болгарія/Сербія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Оновлений сертифікат від уже затвердженого виробника —
подання оновленого сертифікату відповідності Європейській фармакопеї від затвердженого виробника Shandong Xinhua Pharmaceutical CO., LTD, Китай діючої речовини метамізолу натрію моногідрат затверджено: R1-CEP 2001-356-Rev 03;
запропоновано: R1-CEP 2001-356-Rev 04 |
Без рецепта |
UA/7059/01/01 |
| 159. |
СПИРТ КАМФОРНИЙ |
розчин для зовнішнього застосування 10%, спиртовий по 40 мл у флаконах скляних або полімерних; по
40 мл у флаконі скляному або полімерному; по 1 флакону в пачці з картону |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
ПрАТ Фармацевтична фабрика «Віола» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна назви виробника АФІ Камфори рацемічної, без зміни місця виробництва |
Без рецепта |
UA/8343/01/01 |
| 160. |
СТІВАР® |
таблетки, вкриті плівковою оболонкою, по 40 мг; по 28 таблеток у флаконі; по 3 флакони у картонній упаковці з маркуванням українською мовою |
Байєр АГ |
Німеччина |
Байєр АГ |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
незначна зміна на першому етапі синтезу АФІ (проміжного продукту 4-chloro-PMA HCl). (на даний час для утворення 4-chloro-PMA HCl розчин завжди ділився на три рівні частини і кожна частина окремо підлягала обробці до утворення 4-chloro-PMA HCl. Запропоновано більше не ділити розчин в рутинному виробництві, але передбачається, що розчин обробляється в цілому)
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміна розміру серії (включаючи діапазони) АФІ або проміжного продукту, який застосовується у процесі виробництва АФІ (збільшення до 10 разів порівняно із затвердженим розміром) збільшення розміру серії проміжного продукту AFP-Picolinmethylamide на другому етапі синтезу АФІ з 38,1 — 55,7 кг до 76,2 — 111,4 кг. |
За рецептом |
UA/13395/01/01 |
| 161. |
СТРУКТУМ® |
капсули тверді по 500 мг; по 12 капсул у блістері; по 5 блістерів у картонній упаковці; по 20 капсул у блістері; по 3 блістери у картонній упаковці |
П’єр Фабр Медикамент |
Францiя |
П’єр Фабр Медикамент Продакшн |
Францiя |
внесення змін до реєстраційних матеріалів: приведення у відповідність до інструкції для медичного застосування написання умов відпуску в наказі МОЗ України № 1194 від 29.05.2019 в процесі внесення змін (
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — зміна контактних даних уповноваженої особи заявника, відповідальної за здійснення фармаконагляду). Редакція в наказі — за рецептом. Запропонована редакція — без рецепта. |
Без рецепта |
UA/7504/01/01 |
| 162. |
ТЕВАГРАСТИМ |
розчин для ін’єкцій або інфузій по 30 млн. МО/0,5 мл по 0,5 мл (30 млн МО) в скляному шприці одноразового використання з перманентно приєднаною голкою та захисним ковпачком, з або без пристрою для безпечного введення та запобігання поранень голкою чи повторного використання; по 1 шприцу у картонній коробці |
Тева Фармацевтікал Індастріз Лтд. |
Ізраїль |
виробництво за повним циклом; контроль якості: Тева Фармацевтікал Індастріз Лтд., Ізраїль; дозвіл на випуск серії: Тева Фарма Б.В., Нідерланди; контроль якості: ЗАТ СІКОР Біотех, Литва |
Ізраїль/Нідерланди/ Литва |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Зміна у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування на підставі регулярно оновлюваного звіту з безпеки лікарського засобу, або досліджень з безпеки застосування лікарського засобу в післяреєстраційний період, або як результат оцінки звіту з досліджень, проведених відповідно до плану педіатричних досліджень (РІР) (зміну узгоджено з компетентним уповноваженим органом) — зміни внесено в розділ «Особливості застосування» та внесені уточнення в розділ «Спосіб застосування та дози» щодо безпеки лікарського засобу згідно з матеріалами реєстраційного досьє. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/15237/01/01 |
| 163. |
ТЕВАГРАСТИМ |
розчин для ін’єкцій або інфузій по 48 млн. МО/0,8 мл по 0,8 мл (48 млн МО) в скляному шприці одноразового використання з перманентно приєднаною голкою та захисним ковпачком, з або без пристрою для безпечного введення та запобігання поранень голкою чи повторного використання; по 1 шприцу у картонній коробці |
Тева Фармацевтікал Індастріз Лтд. |
Ізраїль |
виробництво за повним циклом; контроль якості: Тева Фармацевтікал Індастріз Лтд., Ізраїль; дозвіл на випуск серії: Тева Фарма Б.В., Нідерланди; контроль якості: ЗАТ СІКОР Біотех, Литва |
Ізраїль/Нідерланди/ Литва |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Зміна у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування на підставі регулярно оновлюваного звіту з безпеки лікарського засобу, або досліджень з безпеки застосування лікарського засобу в післяреєстраційний період, або як результат оцінки звіту з досліджень, проведених відповідно до плану педіатричних досліджень (РІР) (зміну узгоджено з компетентним уповноваженим органом) — зміни внесено в розділ «Особливості застосування» та внесені уточнення в розділ «Спосіб застосування та дози» щодо безпеки лікарського засобу згідно з матеріалами реєстраційного досьє. Введення змін протягом 3-х місяців після затвердження |
За рецептом |
UA/15237/01/02 |
| 164. |
ТЕЛПРЕС ПЛЮС |
таблетки по 40 мг/12,5 мг, по 14 таблеток у блістері; по 2 або по 7 блістерів у картонній пачці |
«КСАНТІС ФАРМА ЛІМІТЕД» |
Кіпр |
Повний цикл виробництва, випуск серії:ЛАБОРАТОРІОС ЛІКОНСА, С.А., Іспанія;Контроль якості:ЛАБОРАТОРІО ДР. Ф. ЕЧЕВАРНЕ, АНАЛІСІС, С.А., Іспанiя |
Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: 2 роки Запропоновано: 3 роки Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/15949/01/01 |
| 165. |
ТЕЛПРЕС ПЛЮС |
таблетки по 80 мг/25 мг, по 14 таблеток у блістері; по 2 або по 7 блістерів у картонній пачці |
«КСАНТІС ФАРМА ЛІМІТЕД» |
Кіпр |
Повний цикл виробництва, випуск серії:ЛАБОРАТОРІОС ЛІКОНСА, С.А., Іспанія;Контроль якості:ЛАБОРАТОРІО ДР. Ф. ЕЧЕВАРНЕ, АНАЛІСІС, С.А., Іспанiя |
Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: 2 роки Запропоновано: 3 роки Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/15949/01/02 |
| 166. |
ТЕЛПРЕС ПЛЮС |
таблетки по 80 мг/12,5 мг, по 14 таблеток у блістері; по 2 або по 7 блістерів у картонній пачці |
«КСАНТІС ФАРМА ЛІМІТЕД» |
Кіпр |
Повний цикл виробництва, випуск серії:ЛАБОРАТОРІОС ЛІКОНСА, С.А., Іспанія;Контроль якості:ЛАБОРАТОРІО ДР. Ф. ЕЧЕВАРНЕ, АНАЛІСІС, С.А., Іспанiя |
Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Стабільність. Зміна у термінах придатності або умовах зберігання готового лікарського засобу (збільшення терміну придатності готового лікарського засобу) — Для торгової упаковки (підтверджується даними реального часу) збільшення терміну придатності готового лікарського засобу на основі позитивних результатів довгострокових досліджень стабільності у реальному часі:
Затверджено: 2 роки Запропоновано: 3 роки Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/15949/01/03 |
| 167. |
ТЕЦЕНТРИК® |
концентрат для розчину для інфузій по 1200 мг/20 мл по 20 мл у флаконі; по 1 флакону у картонній коробці |
Ф.Хоффманн-Ля Рош Лтд |
Швейцарія |
Виробництво нерозфасованої продукції, первинне пакування, випробування контролю якості:Рош Діагностикс ГмбХ, Німеччина;Випробування контролю якості, вторинне пакування, випуск серії:Ф. Хоффманн-Ля Рош Лтд, Швейцарія |
Німеччина/Швейцарія |
внесення змін до реєстраційних матеріалів: зміни II типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування у зв’язку із новими даними з якості, доклінічними, клінічними даними та даними з фармаконагляду — зміни внесено до інструкції для медичного застосування до розділів: «Фармакологічні властивості», «Особливості застосування», «Застосування у період вагітності або годування груддю», «Спосіб застосування та дози», «Побічні реакції» (Введення змін протягом 6-ти місяців після затвердження); зміни II типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у терапевтичних показаннях (додавання нового терапевтичного показання або зміна у затвердженому показанні) — зміни внесено до інструкції для медичного застосування до розділу Показання (Введення змін протягом 6-ти місяців після затвердження); зміни II типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у терапевтичних показаннях (додавання нового терапевтичного показання або зміна у затвердженому показанні) — зміни внесено до інструкції для медичного застосування лікарського засобу до розділу «Показання» (додавання нового терапевтичного показання: Лікування першої лінії у комбінації з бевацизумабом, паклітакселом та карбоплатином пацієнтів з метастатичним неплоскоклітинним недрібноклітинним раком легень без геномних пухлинних аберацій EGFR або ALK) (Введення змін протягом 6-ти місяців після затвердження); зміни II типу — Зміни щодо безпеки/ефективності та фармаконагляду. Зміни у короткій характеристиці лікарського засобу, тексті маркування та інструкції для медичного застосування у зв’язку із новими даними з якості, доклінічними, клінічними даними та даними з фармаконагляду — зміни внесено до інструкції для медичного застосування до розділів: «Фармакологічні властивості», «Особливості застосування», «Спосіб застосування та дози», «Побічні реакції» (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/15872/01/01 |
| 168. |
ТИМОЛОЛ-ДАРНИЦЯ |
краплі очні, розчин, 5 мг/мл, по 5 мл або по 10 мл у флаконі, по 1 флакону в пачці |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (інші зміни) в доповнення до вже затверджених розмірів 80 л, 160 л вводиться додатковий розмір серії ГЛЗ 240 л (на заміну затвердженому розміру 330 л) Затверджено: 80 л, 160 л, 330 л Запропоновано: 80 л, 160 л, 240 л |
За рецептом |
UA/1226/01/02 |
| 169. |
ТИНІДАЗОЛ-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 500 мг по 4 таблетки у блістері; по 1 блістеру у картонній коробці |
ТОВ «Тева Україна» |
Україна |
Балканфарма-Дупниця АТ,Болгарія;Балканфарма-Разград АТ, Болгарія |
Болгарія |
внесення змін до реєстраційних матеріалів: зміна заявника (власника реєстраційного посвідчення) (згідно наказу МОЗ від 23.07.2015 № 460);
Зміни І типу — Зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — зміна уповноваженої особи заявника, відповідальної за здійснення фармаконагляду: Діюча редакція: Dr. Hedva Voliovitch. Пропонована редакція: Orit Stern-Maman. Зміна контактних даних уповноваженої особи. Зміна місця здійснення основної діяльності з фармаконагляду. Зміна адреси мастер-файла |
За рецептом |
UA/6782/01/01 |
| 170. |
ТІВОРТІН® |
розчин для інфузій, 42 мг/мл по 100 мл або по 200 мл у пляшці; по 1 пляшці у пачці |
ТОВ «Юрія-Фарм» |
Україна |
ТОВ «Юрія-Фарм» |
Україна |
внесення змін до реєстраційних матеріалів:технічна помилка у тексті маркування вторинної упаковки лікарського засобу |
За рецептом |
UA/8954/01/01 |
| 171. |
ТІОТРИАЗОЛІН® |
таблетки по 200 мг, по 10 таблеток у блістері; по 3 або по 9 блістерів у пачці; по 15 таблеток у блістері; по 6 блістерів у пачці |
ПАТ «Київмедпрепарат» |
Україна |
ПАТ «Київмедпрепарат» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду — зміни внесені в текст маркування упаковки лікарського засобу щодо зазначення міжнародних позначень одиниць вимірювання. Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/5819/01/02 |
| 172. |
ТОПІРАМАТ |
кристалічний порошок (субстанція) у подвійних поліетиленових пакетах для фармацевтичного застосування |
Товариство з обмеженою відповідальністю «Фармацевтична компанія «Здоров’я» |
Україна |
ЮНІМАРК РЕМЕДІС ЛІМІТЕД |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси заявника (власника реєстраційного посвідчення)- зміна адреси заявника;
Зміни І типу — Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника (включаючи, за необхідності, місце проведення контролю якості), або власника мастер-файла на АФІ, або постачальника АФІ/вихідного матеріалу/реагенту/проміжного продукту, що застосовуються у виробництві АФІ (якщо зазначено у досьє на лікарський засіб) за відсутності сертифіката відповідності Європейській фармакопеї у затвердженому досьє, або виробника нової допоміжної речовини (якщо зазначено у досьє) — уточнення у викладення назви та адреси виробника АФІ Топірамат відповідно до актуальної ліцензії на виробництво;
Зміни І типу — Зміни з якості. АФІ. Контроль АФІ. Зміна у методах випробування АФІ або вихідного матеріалу/проміжного продукту/реагенту, що використовується у процесі виробництва АФІ (інші зміни у методах випробування (включаючи заміну або доповнення) АФІ або вихідного/проміжного продукту) — зміни у методах випробування т. «Залишок сульфамату та сульфату» у зв’язку зі змінами у монографії USP та «Кількісне визначення» внесення уточнень (зміна об’єму інжекції) у зв’язку з приведенням до монографії USP |
— |
UA/12522/01/01 |
| 173. |
ТРАЗОГРАФ® 60% |
розчин для ін’єкцій 60% по 20 мл в ампулі; по 5 ампул упаковані на піднос із термоколу; по 1 підносу у картонній коробці |
«Юнік Фармасьютикал Лабораторіз» (відділення фірми «Дж. Б. Кемікалз енд Фармасьютикалз Лтд.») |
Індія |
«Юнік Фармасьютикал Лабораторіз» (відділення фірми «Дж. Б. Кемікалз енд Фармасьютикалз Лтд.») |
Індія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна у методах випробування готового лікарського засобу т. Бактеріальні ендотоксини, стерильність,
рН — внесення опис методики; кількісне визначення — введення розрахункової формули; механічні включення — зміни формулювання опису методу |
За рецептом |
UA/7388/01/01 |
| 174. |
ТРИЗИПИН® |
таблетки, вкриті оболонкою, по 250 мг по 40 таблеток у банці; по 1 банці в пачці з картону; по 10 таблеток у блістері; по 4 блістери в пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
ТОВ НВФ «Мікрохім» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення методів контролю діючої речовини у р.3.2.S. виробника готового лікарського засобу до вимог ДФУ(діюче видання) за показниками «Ідентифікація», «Хлориди», «Сульфати», «Сульфатна зола», «Вода», «Залишкова кількість органічних розчинників (етанол)» та «Кількісне визначення» |
За рецептом |
UA/12303/02/01 |
| 175. |
ТРИЗИПИН® ЛОНГ |
таблетки пролонгованої дії по 500 мг; по 28 таблеток у банці; по 1 банці в пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
ТОВ НВФ «МІКРОХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення методів контролю діючої речовини у р.3.2.S. виробника готового лікарського засобу до вимог ДФУ(діюче видання) за показниками «Ідентифікація», «Хлориди», «Сульфати», «Сульфатна зола», «Вода», «Залишкова кількість органічних розчинників (етанол)» та «Кількісне визначення» |
За рецептом |
UA/12303/01/01 |
| 176. |
ТРИЗИПИН® ЛОНГ |
таблетки пролонгованої дії по 750 мг; по 28 таблеток у банці; по 1 банці в пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
ТОВ НВФ «МІКРОХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення методів контролю діючої речовини у р.3.2.S. виробника готового лікарського засобу до вимог ДФУ (діюче видання) за показниками «Ідентифікація», «Хлориди», «Сульфати», «Сульфатна зола», «Вода», «Залишкова кількість органічних розчинників (етанол)» та «Кількісне визначення» |
За рецептом |
UA/12303/01/02 |
| 177. |
ТРИЗИПИН® ЛОНГ |
таблетки пролонгованої дії по 1000 мг; по 28 таблеток у банці; по 1 банці в пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
ТОВ НВФ «МІКРОХІМ» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення методів контролю діючої речовини у р.3.2.S. виробника готового лікарського засобу до вимог ДФУ (діюче видання) за показниками «Ідентифікація», «Хлориди», «Сульфати», «Сульфатна зола», «Вода», «Залишкова кількість органічних розчинників (етанол)» та «Кількісне визначення» |
За рецептом |
UA/12303/01/03 |
| 178. |
ТРИЗИПІН |
розчин для ін’єкцій, 100 мг/мл, по 5 мл в ампулі; по 5 ампул у касеті; по 2 касети у пачці з картону |
ТОВ НВФ «МІКРОХІМ» |
Україна |
відповідальний за виробництво та контроль/випробування серії, не включаючи випуск серії:
Приватне акціонерне товариство «Лекхім-Харків», Україна
відповідальний за виробництво та контроль/випробування серії, включаючи випуск серії:
ТОВ НВФ «МІКРОХІМ»,Україна |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — приведення методів контролю діючої речовини у р.3.2.S. виробника готового лікарського засобу до вимог ДФУ (діюче видання) за показниками «Ідентифікація», «Хлориди», «Сульфати», «Сульфатна зола», «Вода», «Залишкова кількість органічних розчинників (етанол)» та «Кількісне визначення» |
За рецептом |
UA/9897/01/01 |
| 179. |
УНДЕТАБ |
таблетки, вкриті оболонкою, по 10 таблеток у блістері; по 3 блістери в пачці; по 50 таблеток у контейнері (баночці); по 1 контейнеру (баночці) в пачці |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
АТ «КИЇВСЬКИЙ ВІТАМІННИЙ ЗАВОД» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Новий сертифікат від вже затвердженого виробника —
подання нового Сертифікату R0-CEP 2013-165-Rev 01 для АФІ Піридоксину гідрохлорид від вже затвердженого виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай, як наслідок вилучення зі специфікації АФІ контроль за показником «Важкі метали» для виробника Jiangxi Tianxin Pharmaceutical Co., Ltd., Китай. |
Без рецепта |
UA/4834/01/01 |
| 180. |
ФАМУЛАН® |
краплі оральні, по 20 або 50, або 100 мл у флаконі-крапельниці; по 1 флакону-крапельниці у картонній упаковці |
Ріхард Біттнер АГ |
Австрія |
Ріхард Біттнер АГ |
Австрія |
внесення змін до реєстраційних матеріалів: приведення у відповідність до інструкції для медичного застосування написання умов відпуску в наказі МОЗ України № 1212 від 30.05.2019 в процесі внесення змін (
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду. Введення або зміни до узагальнених даних про систему фармаконагляду (введення узагальнених даних про систему фармаконагляду, зміна уповноваженої особи, відповідальної за здійснення фармаконагляду; контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні, якщо вона відмінна від уповноваженої особи, відповідальної за здійснення фармаконагляду (включаючи контактні дані) та/або зміни у розміщенні мастер-файла системи фармаконагляду) — зміна контактних даних контактної особи з фармаконагляду заявника для здійснення фармаконагляду в Україні). Редакція в наказі — за рецептом. Запропонована редакція — без рецепта. |
Без рецепта |
UA/14131/01/01 |
| 181. |
ФЕРВЕКС ДЛЯ ДІТЕЙ |
порошок для орального розчину, 8 саше у картонній коробці |
УПСА САС |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1998-047-Rev 06 для діючої речовини Paracetamol від вже затвердженого виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/7600/01/01 |
| 182. |
ФЕРВЕКС ДЛЯ ДОРОСЛИХ |
порошок для орального розчину, по 8 саше у картонній коробці |
УПСА САС |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1998-047-Rev 06 для діючої речовини Paracetamol від вже затвердженого виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/7741/01/01 |
| 183. |
ФЕРВЕКС ДЛЯ ДОРОСЛИХ З МАЛИНОВИМ СМАКОМ |
порошок для орального розчину, 8 саше у картонній коробці |
УПСА САС |
Францiя |
УПСА САС |
Францiя |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1998-047-Rev 06 для діючої речовини Paracetamol від вже затвердженого виробника;
Зміни І типу — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 1996-039-Rev 04 для діючої речовини Paracetamol від вже затвердженого виробника для якого відбулась зміна назви без зміни адреси виробника |
Без рецепта |
UA/3128/01/01 |
| 184. |
ФЛУТАФАРМ® ФЕМІНА |
таблетки по 0,125 г по 10 таблеток у блістері; по 5 блістерів у пачці з картону |
ПАТ «Фармак» |
Україна |
ПАТ «Фармак» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — введення періодичності контролю готового лікарського засобу за показником «МБЧ» (контроль здійснюється з періодичністю першу та кожну десяту наступну серії, але не менше 1 серії в рік);
Зміни І типу — зміни до методів контролю готового лікарського засобу за показником «МБЧ», а саме: вилучення повного викладу проведення аналізу та зазначення посилань на загальні статті ЕР*, ДФУ* діюче видання. Метод проведення випробування та критерії прийнятності не змінилися |
За рецептом |
UA/14087/01/01 |
| 185. |
ФОРКСІГА |
таблетки, вкриті плівковою оболонкою, по 5 мг; по 10 таблеток у блістері; по 3 блістери в картонній коробці |
АСТРАЗЕНЕКА ЮК Лімітед |
Велика Британiя |
Виробник «in bulk»:
Брістол-Майєрс Сквібб Мануфактурінг Компані, США
Виробник, відповідальний за первинне та вторинне пакування, випуск серії:
АстраЗенека ЮК Лімітед, Велика Британія
Виробник, відповідальний за контроль якості:
АстраЗенека АБ, Швеція
Виробник «in bulk»:
АстраЗенека Фармасьютикалс ЛП, США |
США/Велика Британія/Швеція |
внесення змін до реєстраційних матеріалів:виправлення технічної помилки у МКЯ, у специфікації на випуск за розділом «Кількісне визначення» |
За рецептом |
UA/13302/01/01 |
| 186. |
ФОРКСІГА |
таблетки, вкриті плівковою оболонкою, по 10 мг; по 10 таблеток у блістері; по 3 блістери в картонній коробці |
АСТРАЗЕНЕКА ЮК Лімітед |
Велика Британiя |
Виробник «in bulk»:
Брістол-Майєрс Сквібб Мануфактурінг Компані, США
Виробник, відповідальний за первинне та вторинне пакування, випуск серії:
АстраЗенека ЮК Лімітед, Велика Британія
Виробник, відповідальний за контроль якості:
АстраЗенека АБ, Швеція
Виробник «in bulk»:
АстраЗенека Фармасьютикалс ЛП, США |
США/Велика Британія/Швеція |
внесення змін до реєстраційних матеріалів:виправлення технічної помилки у МКЯ, у специфікації на випуск за розділом «Кількісне визначення» |
За рецептом |
UA/13302/01/02 |
| 187. |
ФСМЕ-ІМУН ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ КЛІЩОВОГО ЕНЦЕФАЛІТУ КУЛЬТУРАЛЬНА ІНАКТИВОВАНА ОЧИЩЕНА СОРБОВАНА |
суспензія для ін’єкцій по 2,4 мкг/0,5 мл (1 доза для дорослих), по 0,5 мл суспензії у попередньо заповненому одноразовому шприці; по 1 шприцу вкладеному у блістер; по 1 блістеру та окремою голкою у картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво продукту у формі in bulk; наповнення шприців: Бакстер АГ, Австрія; контроль якості; пакування; маркування: Бакстер АГ, Австрія; контроль якості: Бакстер АГ, Австрія; контроль якості; випуск серії: Пфайзер Менюфекчуринг Австрія ГмбХ, Австрія |
Австрія |
внесення змін до реєстраційних матеріалів:виправлення технічної помилки у Інструкції для медичного застосування (розділ «Склад») пункт «Якісний та кількісний склад лікарського засобу |
За рецептом |
UA/16695/01/01 |
| 188. |
ФСМЕ-ІМУН ДЖУНІОР ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ КЛІЩОВОГО ЕНЦЕФАЛІТУ КУЛЬТУРАЛЬНА ІНАКТИВОВАНА ОЧИЩЕНА СОРБОВАНА |
суспензія для ін’єкцій по 1,2 мкг/0,25 мл (1 доза для дітей), по 0,25 мл суспензії у попередньо заповненому одноразовому шприці; по 1 шприцу вкладеному у блістер; по 1 блістеру та окремою голкою у картонній коробці |
ПФАЙЗЕР ЕЙЧ.СІ.ПІ. КОРПОРЕЙШН |
США |
виробництво продукту у формі in bulk; наповнення шприців: Бакстер АГ, Австрія; контроль якості; пакування; маркування: Бакстер АГ, Австрія; контроль якості: Бакстер АГ, Австрія; контроль якості; випуск серії: Пфайзер Менюфекчуринг Австрія ГмбХ, Австрія |
Австрія |
внесення змін до реєстраційних матеріалів:виправлення технічної помилки у Інструкції для медичного застосування (розділ «Склад») пункт «Якісний та кількісний склад лікарського засобу |
За рецептом |
UA/16694/01/01 |
| 189. |
ФУРОСЕМІД-ДАРНИЦЯ |
розчин для ін’єкцій, 10 мг/мл; по 2 мл в ампулі; по 10 ампул у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці в пачці; по 2 мл в ампулі; по 5 ампул у контурній чарунковій упаковці; по 2 контурні чарункові упаковки в пачці |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
ПрАТ «Фармацевтична фірма «Дарниця» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміни щодо безпеки/ефективності та фармаконагляду — введення альтернативного тексту маркування вторинної упаковки лікарського засобу з внесенням незначних змін до тексту маркування, з можливістю нанесення 2D коду на додаток до вже затвердженого тексту маркування (без зазначення 2D коду). Введення змін протягом 6-ти місяців після затвердження |
За рецептом |
UA/2353/02/01 |
| 190. |
ХМЕЛЮ ШИШОК ЕКСТРАКТ РІДКИЙ |
екстракт рідкий (субстанція) в бочках полімерних для виробництва нестерильних лікарських форм |
ПАТ «Галичфарм» |
Україна |
ПАТ «Галичфарм» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. АФІ. Виробництво. Зміни в процесі виробництва АФІ (незначна зміна у процесі виробництва АФІ)
внесення змін до розділу 3.2.S.2. Процес виробництва АФІ, зокрема: викладення тексту короткого опису технологічного процесу та технологічної схеми виробництва АФІ в новій редакції. |
— |
UA/12525/01/01 |
| 191. |
ХОНДРА-СИЛА® |
мазь 5%, по 30 г у тубі; по 1 тубі в пачці з картону |
ПАТ «Фармак» |
Україна |
ПАТ «Фармак» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу — введення додаткового розміру серії готового лікарського засобу — 600 кг |
Без рецепта |
UA/6033/01/01 |
| 192. |
ХОНДРОСАТ |
розчин для ін’єкцій, 100 мг/мл; по 2 мл в ампулі; по 5 ампул у блістері; по 2 блістери в пачці з картону |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
ТОВ «ФЗ «БІОФАРМА» |
Україна |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна розміру серії (включаючи діапазон розміру серії) готового лікарського засобу (збільшення до 10 разів порівняно із затвердженим розміром) введення додаткового розміру серії готового лікарського засобу. Затверджено: 50 000 ампул Запропоновано: 50 000 ампул;100 000 ампул |
За рецептом |
UA/14288/01/01 |
| 193. |
ЦЕТИРИЗИН-ТЕВА |
таблетки, вкриті плівковою оболонкою, по 10 мг, по 7 таблеток у блістері; по 1 блістеру у коробці; по 10 таблеток у блістері; по 1 або по 2, або по 3, або по 5 блістерів у коробці |
Тева Фармацевтікал Індастріз Лтд. |
Ізраїль |
Меркле ГмбХ, Німеччина;
Виробництво нерозфасованого продукту, дозвіл на випуск серії:
Первинна та вторинна упаковка, контроль якості: |
Німеччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — подання оновленого сертифікату відповідності Європейської фармакопеї № R1-CEP 2003-171-Rev 02 від вже затвердженого виробника АФІ цетиризину дигідрохлориду зі зміною назви виробника;
Зміни І типу — подання оновленого сертифікату відповідності Європейської фармакопеї № R1-CEP 2004-047-Rev 04 від вже затвердженого виробника АФІ цетиризину дигідрохлориду зі зміною назви виробника. Введення змін протягом 6-ти місяців після затвердження |
Без рецепта |
UA/7158/01/01 |
| 194. |
ЦЕФАЗОЛІН |
порошок для розчину для ін’єкцій по 1,0 г, 1 або 5, або 50 флаконів з порошком у пачці з картону; 1 флакон з порошком та 1 ампула з розчинником (вода для ін’єкцій) по 10 мл в блістері; по 1 блістеру в пачці з картону |
Приватне акціонерне товариство «Лекхім-Харків» |
Україна |
Приватне акціонерне товариство «Лекхім-Харків», Україна
(пакування із форми in bulk фірми-виробника Квілу Фармацеутікал Ко. Лтд., Китай) |
Україна/ Китай |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу (незначна зміна у процесі виробництва) внесення змін до розділу 3.2.Р.3. Процес виробництва лікарського засобу, зокрема: зміна режиму стерилізації гумових пробок та вилучення тесту на водяний вміст для гумових пробок. (Затверджено: 121? С протягом 30 хвилин; Запропоновано: 121? С протягом 20 хвилин).
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна параметрів специфікацій та/або допустимих меж первинної упаковки готового лікарського засобу (вилучення незначного показника (наприклад застарілого показника)) Супутня зміна
— Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна у методах випробування первинної упаковки готового лікарського засобу (незначні зміни у затверджених методах випробувань) внесення змін до розділу 3.2.Р.7.Система контейнер/закупорювальний засіб, зокрема: вилучення зі специфікації первинної упаковки ГЛЗ (гумові пробки) тесту на еластичність за показником «Ідентифікація». |
За рецептом |
UA/15387/01/01 |
| 195. |
ЦЕФАЗОЛІН |
порошок для розчину для ін’єкцій по 1,0 г, in bulk: 50 флаконів з порошком у коробках з картону |
Приватне акціонерне товариство «Лекхім-Харків» |
Україна |
Квілу Фармацеутікал Ко. Лтд., |
Китай |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміни у процесі виробництва готового лікарського засобу, включаючи проміжний продукт, що застосовується при виробництві готового лікарського засобу (незначна зміна у процесі виробництва) внесення змін до розділу 3.2.Р.3. Процес виробництва лікарського засобу, зокрема: зміна режиму стерилізації гумових пробок та вилучення тесту на водяний вміст для гумових пробок. (Затверджено: 121? С протягом 30 хвилин; Запропоновано: 121? С протягом 20 хвилин).
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна параметрів специфікацій та/або допустимих меж первинної упаковки готового лікарського засобу (вилучення незначного показника (наприклад застарілого показника)) Супутня зміна
— Зміни з якості. Готовий лікарський засіб. Система контейнер/закупорювальний засіб. Зміна у методах випробування первинної упаковки готового лікарського засобу (незначні зміни у затверджених методах випробувань) внесення змін до розділу 3.2.Р.7.Система контейнер/закупорювальний засіб, зокрема: вилучення зі специфікації первинної упаковки ГЛЗ (гумові пробки) тесту на еластичність за показником «Ідентифікація». |
— |
UA/15381/01/01 |
| 196. |
ЦИМЕВЕН® |
ліофілізат для розчину для інфузій по 500 мг; 1 флакон з ліофілізатом у картонній коробці |
Ф.Хоффманн-Ля Рош Лтд |
Швейцарія |
Виробництво нерозфасованої продукції, первинне пакування:Ф.Хоффманн-Ля Рош Лтд, Швейцарія;Виробництво нерозфасованої продукції, первинне пакування, випробування контролю якості:БСП Фармасьютікалз С.п.А., Італія;Вторинне пакування, випробування контролю якості, випуск серії:Ф.Хоффманн-Ля Рош Лтд, Швейцарія |
Швецарія/Італія |
внесення змін до реєстраційних матеріалів: зміни I типу: Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, включаючи випуск серій) — зміна назви і адреси (з юридичної на фактичну) виробника ГЛЗ, відповідального за випуск серії, без зміни місця виробництва. Зміни внесені в інструкцію для медичного застосування щодо найменування та місцезнаходження виробника, як наслідок — відповідні зміни у текст маркування упаковки лікарського засобу. Введення змін протягом 6-ти місяців після затвердження; зміни I типу: Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, не включаючи випуск серій) — зміна назви і адреси виробника, відповідального за виробництво нерозфасованої продукції, первинне пакування, випробування контролю якості, без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження); зміни I типу: Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) — вилучення виробничої дільниці Ф.Хоффманн-Ля Рош Лтд, Базель, Швейцарія, відповідальної за випробування контролю якості (Введення змін протягом 6-ти місяців після затвердження); зміни I типу: Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) — вилучення виробничої дільниці Пар Стеріл Продактс, ЛЛСі, США, відповідальної за виробництво нерозфасованої продукції та первинне пакування (Введення змін протягом 6-ти місяців після затвердження); зміни I типу: Адміністративні зміни. Вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини (якщо зазначено у досьє) — вилучення виробничої дільниці Рош Фарма АГ, відповідальної за випробування контролю якості (Введення змін протягом 6-ти місяців після затвердження); зміни I типу: Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, не включаючи випуск серій) — зміна назви і адреси виробника відповідального за вторинне пакування та випробування контролю якості, без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження); зміни I типу: Адміністративні зміни. Зміна найменування та/або адреси місця провадження діяльності виробника/імпортера готового лікарського засобу, включаючи дільниці випуску серії або місце проведення контролю якості. (діяльність, за яку відповідає виробник/імпортер, не включаючи випуск серій) — зміна назви і адреси виробничої дільниці, відповідальної за виробництво нерозфасованої продукції та первинне пакування, без зміни місця виробництва (Введення змін протягом 6-ти місяців після затвердження) |
За рецептом |
UA/10598/01/01 |
| 197. |
ЦИПРИНОЛ® |
таблетки, вкриті плівковою оболонкою, по 750 мг по 10 таблеток у блістері; по 1 або 2 блістери в картонній коробці |
КРКА, д.д., Ново место |
Словенія |
виробництво «in bulk», первинне та вторинне пакування, контроль та випуск серії:
КРКА, д.д., Ново место, Словенія;
контроль серії:
КРКА, д.д., Ново место, Словенія;
контроль серії:
НЛЗОХ (Національні лабораторія за здрав’є, околє ін храно), Словенія |
Словенія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Оновлений сертифікат від уже затвердженого виробника — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2000-405-Rev 10 для діючої речовини Ciprofloxacin Hydrochloride від вже затвердженого виробника Neuland Laboratories Limited, як наслідок зміна адреси виробничої ділянки;
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Оновлений сертифікат від уже затвердженого виробника — подання оновленого сертифіката відповідності Європейській фармакопеї № R1-CEP 2000-405-Rev 09 (затверджено: R1-CEP 2000-405-Rev 08) для діючої речовини Ciprofloxacin Hydrochloride від вже затвердженого виробника Neuland Laboratories Limited, як наслідок зміна адреси власника СЕР та виробничої ділянки;
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна імпортера/зміни, що стосуються випуску серії та контролю якості готового лікарського засобу (заміна або додавання дільниці, на якій здійснюється контроль/випробування серії) — введення додаткової дільниці ГЛЗ для контролю серії КРКА, д.д., Ново место, Словенія Повхова уліца 5, 8501 Ново место, Словенія та зазначення виробничих функцій для затвердженого виробника ГЛЗ КРКА, д.д., Ново место, Словенія Шмар’єшка цеста 6, 8501 Ново место, Словенія (виробник «in bulk», первинне та вторинне пакування, контроль та випуск серії);
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Оновлений сертифікат від уже затвердженого виробника — подання оновленого сертифіката відповідності Європейській фармакопеї № CЕР № R1-CEP 2006-045-Rev 01 для діючої речовини Ciprofloxacin Hydrochloride від вже затвердженого виробника із зміною назви власника СЕР та виробничої ділянки (запропоновано: Hangzhou Huadong Medicine Group Zhejiang Huayi Pharmaceutical Co., Ltd);
Зміни І типу — Зміни з якості. Сертифікат відповідності/ГЕ-сертифікат відповідності Європейській фармакопеї/монографії. Подання нового або оновленого сертифіката відповідності або вилучення сертифіката відповідності Європейській фармакопеї: для АФІ; для вихідного матеріалу/реагенту/проміжного продукту, що використовуються у виробництві АФІ; для допоміжної речовини (сертифікат відповідності Європейській фармакопеї) — Оновлений сертифікат від уже затвердженого виробника — подання оновленого сертифіката відповідності Європейській фармакопеї № CЕР № R1-CEP 2006-045-Rev 00 (затверджено: CЕР № R0-CEP 2006-045-Rev 01) для діючої речовини Ciprofloxacin Hydrochloride від вже затвердженого виробника Zhejiang Huayi Pharmaceutical Co. Ltd з відповідними змінами у адресі власника СЕР та виробничої ділянки;
Зміни І типу — Зміни з якості. Готовий лікарський засіб. Зміни у виробництві. Зміна імпортера/зміни, що стосуються випуску серії та контролю якості готового лікарського засобу (заміна або додавання дільниці, на якій здійснюється контроль/випробування серії) — введення додаткової дільниці ГЛЗ для контролю серії НЛЗОХ (Національні лабораторія за здрав’є, околє ін храно), Словенія Далматінова уліца 3, 8000 Ново место, Словенія |
За рецептом |
UA/0678/02/01 |
| 198. |
ЦИПРОБЕЛ® |
таблетки, вкриті оболонкою, по 500 мг по 7 таблеток у блістері; по 2 блістери в картонній упаковці; по 4 таблетки у блістері; по 1 блістеру в картонній упаковці; по 14 таблеток у блістері; по 1 блістеру в картонній упаковці |
НОБЕЛ ІЛАЧ САНАЇ ВЕ ТІДЖАРЕТ А.Ш. |
Туреччина |
НОБЕЛ ІЛАЧ САНАЇ ВЕ ТІДЖАРЕТ А.Ш. |
Туреччина |
внесення змін до реєстраційних матеріалів:
Зміни І типу — зміна параметрів специфікацій та/або допустимих меж готового лікарського засобу — зміна до специфікації за показником «Залишкові кількості органічних розчинників», ліміти приведено у відповідність до вимог настанов ІСН щодо якості оновлених матеріалів фірми — виробника;
Зміни І типу — зміна у методах випробування готового лікарського засобу — зміна до методів контролю готового лікарського засобу за показником «Залишкові кількості органічних розчинників», приведено у відповідність до якості оновлених матеріалів фірми — виробника (зміна устаткування, колонки, приготування розчинів, умов придатності системи та розрахунків) |
За рецептом |
UA/5015/01/01 |
| 199. |
ЦИТРАФЛІТ |
порошок для орального розчину по 15,08 г порошку в пакеті-саше; по 2 пакети або 50 пакетів (упаковка для лікувальних закладів) у картонній коробці |
Касен Рекордаті, С.Л. |
Іспанiя |
виробник нерозфасованої продукції: Лабораторіос Сальват, СА, Іспанія; первинна та вторинна упаковка, дозвіл на випуск серії: Касен Рекордаті, С.Л., Іспанія |
Іспанія |
внесення змін до реєстраційних матеріалів:
Зміни І типу — вилучення виробничої дільниці (включаючи дільниці для АФІ, проміжного продукту або готового лікарського засобу, дільниці для проведення пакування, виробника, відповідального за випуск серій, місце проведення контролю серії) або постачальника вихідного матеріалу, реагенту або допоміжної речовини — вилучення затвердженого виробника АФІ для магнію оксиду легкого Societa Generale per L’Indastria della Magnesia S.p.A., Italy |
За рецептом |
UA/13820/01/01 |
 ЕВОХАЛЕР
ЕВОХАЛЕР
 Боковой амиотрофический склероз (БАС) является прогрессирующим нейродегенеративным заболеванием, которое приводит к гибели нервных клеток, контролирующих движение. В результате развития данной патологии пациенты не могут двигаться и, в конце концов, дышать. БАС смертелен и до сих пор неизлечим. Могут ли открытия дать надежду на новые методы лечения?
Боковой амиотрофический склероз (БАС) является прогрессирующим нейродегенеративным заболеванием, которое приводит к гибели нервных клеток, контролирующих движение. В результате развития данной патологии пациенты не могут двигаться и, в конце концов, дышать. БАС смертелен и до сих пор неизлечим. Могут ли открытия дать надежду на новые методы лечения?
 2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.
2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.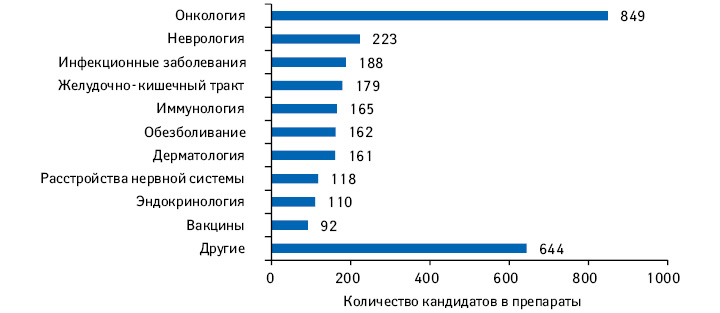
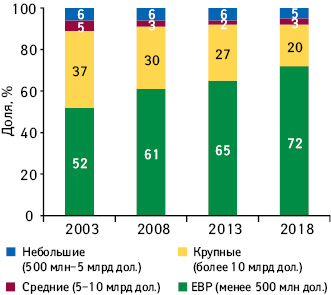
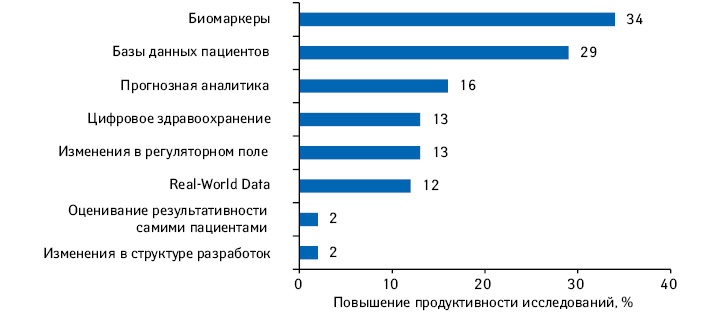
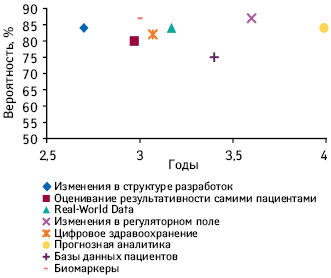
 Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 17 июня предоставило «Merck & Co., Inc.» разрешение на маркетинг Recarbrio (имипенем, циластатин и релабактам) — антибактериального лекарственного препарата для лечения взрослых с осложненными инфекциями мочевыводящих путей (ОИМП) и осложненными внутрибрюшными инфекциями (ОВБИ).
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 17 июня предоставило «Merck & Co., Inc.» разрешение на маркетинг Recarbrio (имипенем, циластатин и релабактам) — антибактериального лекарственного препарата для лечения взрослых с осложненными инфекциями мочевыводящих путей (ОИМП) и осложненными внутрибрюшными инфекциями (ОВБИ). Европейская комиссия 17 июля сообщила о начале официального антимонопольного расследования для оценки, нарушает ли использование Amazon конфиденциальных данных независимых розничных продавцов, правила конкуренции ЕС.
Европейская комиссия 17 июля сообщила о начале официального антимонопольного расследования для оценки, нарушает ли использование Amazon конфиденциальных данных независимых розничных продавцов, правила конкуренции ЕС. Державна служба України з лікарських засобів та контролю за наркотиками в Закарпатській обл. (далі — Держлікслужба) звітує про виконану роботу протягом І півріччя 2019 р.
Державна служба України з лікарських засобів та контролю за наркотиками в Закарпатській обл. (далі — Держлікслужба) звітує про виконану роботу протягом І півріччя 2019 р. Ученые обсуждают эффективность антидепрессантов уже на протяжении нескольких десятилетий. В последнее время исследователи сталкиваются с тем фактом, что существует достаточно мало доказательств того, что антидепрессанты работают лучше, чем плацебо.
Ученые обсуждают эффективность антидепрессантов уже на протяжении нескольких десятилетий. В последнее время исследователи сталкиваются с тем фактом, что существует достаточно мало доказательств того, что антидепрессанты работают лучше, чем плацебо.  Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена.
Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена. Державна служба України з лікарських засобів та контролю за наркотиками (далі — Держлікслужба) у Чернігівській обл. надає інформацію щодо здійснення ринкового нагляду за І півріччя 2019 р.
Державна служба України з лікарських засобів та контролю за наркотиками (далі — Держлікслужба) у Чернігівській обл. надає інформацію щодо здійснення ринкового нагляду за І півріччя 2019 р. Наприкінці червня європейська база EudraGMDP поповнилася двома новими сертифікатами GMP, які були видані регуляторним органом Польщі АТ «Фармак» на 2 виробничі дільниці та нову складську дільницю, введену в експлуатацію на початку цього року. Дві виробничі дільниці пройшли планову ресертифікацію та підтвердили свою відповідність вимогам GMP ЄС. Складська дільниця інспектувалася європейським органом вперше.
Наприкінці червня європейська база EudraGMDP поповнилася двома новими сертифікатами GMP, які були видані регуляторним органом Польщі АТ «Фармак» на 2 виробничі дільниці та нову складську дільницю, введену в експлуатацію на початку цього року. Дві виробничі дільниці пройшли планову ресертифікацію та підтвердили свою відповідність вимогам GMP ЄС. Складська дільниця інспектувалася європейським органом вперше. Поскольку актуальной и полной общедоступной информации о ценах на лекарственные средства в разных странах очень мало, а отечественная практика реимбурсации находится на начальных этапах развития, любые параллели применительно к текущей ситуации в данной сфере кажутся интересными.
Поскольку актуальной и полной общедоступной информации о ценах на лекарственные средства в разных странах очень мало, а отечественная практика реимбурсации находится на начальных этапах развития, любые параллели применительно к текущей ситуации в данной сфере кажутся интересными. На засіданні Кабінету Міністрів України, що відбулося 17 липня, посадовці розглянули проблеми сфери охорони здоров’я, перша з яких стосувалася надання квот на виробництво спирту для фармацевтичних підприємств.
На засіданні Кабінету Міністрів України, що відбулося 17 липня, посадовці розглянули проблеми сфери охорони здоров’я, перша з яких стосувалася надання квот на виробництво спирту для фармацевтичних підприємств.