Каждый, кто в наше хронически непростое время всерьез занимается бизнесом, наверное, хотел бы иметь свой «ядерный чемоданчик»: нажал на кнопочку — и конкурентное поле зачищено. И совершенно неважно, добросовестными были ваши конкуренты или не очень — их отсутствие и есть лучший результат конкурентной борьбы.
Патент как оружие массового поражения
![]() Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена.
Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена.
Причем, как показывает практика последних лет 10, для ее обретения не нужно никаких творческих вкладов, как это было принято в прошлые века, — достаточно одного лишь желания, а мечтам, как известно, свойственно исполняться.
Мы уже писали о том, как в начале 2014 г. 21-летняя студентка Львовского университета «Политехника» Анастасия Штукалюк запатентовала обычную спичку и все ее модификации, став правообладателем патентов на промышленные образцы «СПИЧКА» № 26413 от 10.02.2014 г. и № 26298 от 27.01.2014 г.
Взмах волшебной деревянной палочки «КЦ» — и ведущее украинское предприятие деревообрабатывающей промышленности, известное еще с советских времен, приостановило свою внешнеэкономическую деятельность, поскольку для того, чтобы выполнить зарубежный заказ, необходимо было получить разрешение г-жи Штукалюк, заботливо внесшей свои патенты на промобразцы в Таможенный реестр объектов интеллектуальной собственности, которым руководствуются таможенные органы при оформлении грузов.
Патент (как это было со «Спичкой») мигом отправляет стандартную продукцию предприятия в раздел контрафактной и «вынуть» ее оттуда можно лишь после вступления в силу и исполнения решения суда об отмене таких «спичечных» патентов.
Да, но где же тут творческая составляющая, спросит пытливый читатель.
Можно проявить ее в названии продукта. Помните фильм «Кин-дза-дза», где волшебные «КЦ» открывали порталы Вселенной? Думаете, режиссер этого фильма имеет какие-то права на эти названия? Нет — согласно госреестру зарегистрированных торговых марок Украины правовладельцем украинских государственных регистраций оригинальных знаков Кин-Дза-Дза (свидетельство Украины № 67500); КЦ (№ 96115); Полная КинДзаДза (№ 76012); Гравицапа (№ 67499); Gravitsapa (№ 67498) является не Г. Данелия, а Е. Куча.
Впрочем, прогресс не стоит на месте: не знаю, какие конкурентные преимущества сегодня могут дать приватизированные объекты чьих-то авторских прав, если можно получить монополию не только на сказочных персонажей, но и стать законным обладателем всей «красной дорожки» успеха.
Формула успеха в фармбизнесе
Зачем, спрашивается, забивать себе голову таблицей умножения, если в каждом смартфоне есть калькулятор? «Знания порождают скорбь», — это еще Экклезиаст говорил.
Вот не помнила бы я правил Международного союза теоретической и прикладной химии (IUPAC) — запатентовала бы весь класс пиридинов, назвав их производными азабензола, — и все: монополия на целый сегмент аптечного ассортимента обеспечена. Но это я просто завидую чужому успеху, который невозможно повторить, ибо превзойти «Черный квадрат» К. Малевича уже не под силу никому — гениальнее было бы разве что продавать метр холста по цене шедевра.
Безусловно, интеллектуальная собственность — необходимая составляющая формулы успеха в бизнесе, но главный ее признак в конце второго десятилетия XXI в. — это отсутствие инноваций. Фактически патент сегодня стал оружием конкурентной борьбы, позволяющим «прихватизировать» хорошо забытое старое, не внося никаких инвестиций в доставшийся с советских времен «свечной заводик».
Развивая национальное законодательство по интеллектуальной собственности, мы настолько упростили получение патентной охраны любого бытового объекта, что даже странно, как это до сих пор никто не «изобрел» и не запатентовал обычное колесо и состав воздуха, обретя монополию на жизнь и движение в стране на ближайшие 20 лет.
Но кроме изобретений, необходимыми условиями патентования которых еще формально остаются мировая новизна и изобретательский уровень, патентной охране подлежат их «младшие сестры» — полезные модели, регистрация которых осуществляется по «явочной» системе. Еще недавно объектом полезной модели могло быть только устройство в любой сфере технологий. Сегодня же таким объектом может быть любой продукт (устройство, вещество, состав препарата и т.п.) или процесс.
Так, в своей практике мне не раз приходилось сталкиваться с запатентованными в качестве полезных моделей известными из Государственной Фармакопеи СССР лекарствами, причем как их составом («диклофенак плюс тальк»), так и химическими формулами лекарственных средств (промедол, морфин и пр.).
Сложилась парадоксальная ситуация: давно зарегистрированное в Украине лекарство из разряда генериков (препаратов, давно утративших патентную защиту) при ввозе в Украину оказывается в списке контрафактных товаров, выйти из которого можно, лишь «убив» доморощенный патент в судебном порядке.
Причем на фоне таких примеров, как патент на формулу действующего вещества препарата, известного еще из трудов алхимиков Средневековья, проблема «вечнозеленых» патентов (способы лечения, диагностики, связанные с лекарственными средствами, давно утратившими патентную защиту) не кажется такой уж серьезной.
Но здесь я хочу остановиться на критериях «известности» лекарственных средств, основанных на использовании разных по времени редакций классификаций органических соединений и международных номенклатур.
Так, правилами систематической номенклатуры IUPAC1 подчеркивается, что они не обязательно дают уникальное название для каждого соединения (то есть могут существовать разные названия одного вещества, не противоречащие правилам IUPAC), но эти названия всегда будут однозначными (одному названию будет соответствовать только одно вещество).
Вот вам и рецепт формулы успеха: вы не сможете запатентовать формулу уксусной кислоты, зато я смогу запатентовать этановую.
А уж структурная формула вещества CH3COOH дает нам поистине широчайшие возможности для маневра.
«И звезды светят мне красиво, и симпатичен ад»2
«Не могу не воздать похвалу тому, кто первым извлек из маковых головок морфий», — писал Михаил Булгаков в 1927 г. (рассказ «Морфий»). Через 90 лет (в конце 2017 г.) его химическая формула была запатентована в Украине в качестве полезной модели по патенту Украины № 120761 «Лекарственный препарат обезболивающего и спазмолитического действия «Морфин».
Еще три патента №№ 120762-120764 были выданы на лекарственные препараты обезболивающего и спазмолитического действия «Диазепам», «Промедол» и «Фентанил».
Причем в состав таблеток диазепама кроме нового действующего вещества были введены еще некие «усилители» (в частности, анальгетики и антидепрессанты), видимо, позволяющие современной медицине не только победить боль, но заодно и одолеть бич XXI в. — ее Величество Депрессию.
Впрочем, сам диазепам по сравнению с морфином еще сравнительно «новичок»: именно морфин, открытый в 1803 г., стал родоначальником группы сильнодействующих лекарств (среди побочных эффектов — эйфория и «героическая» работоспособность), с развитием применения которых смерть от болевого шока в медицинских учреждениях стала редкостью.
Широкое медицинское применение препарата и выявленные при этом приятные побочные реакции обусловили его популярность, о чем свидетельствуют многие литературные и художественные произведения: «…нормально человек может работать только после укола морфия. В самом деле: куда, к чёрту, годится человек, если малейшая невралгийка может выбить его совершенно из седла!», — писал Михаил Булгаков в 1927 г. (рассказ «Морфий»).
Весной 2018 г. из «седла», правда, нас выбила не «невралгийка», а вышеупомянутые патенты, которыми, как козырными тузами, были «биты» все лицензии, регистрационные удостоверения и прочие разрешительные документы, необходимые для ввоза морфина и других сильнодействующих лекарственных средств в Украину.
В течение месяца были собраны все документы, позволяющие представить историю создания этих препаратов и ретроспективу их упоминаний в отраслевых справочниках и стандартах, были проведены экспертизы и получены заключения, выводы которых давали основания суду признать патенты Украины № 120761, № 120762, № 120763 и № 120764 от 10.11.2017 г. недействительными, так как они не соответствуют условиям патентоспособности: охраняемые ими полезные модели не являются новыми, а наоборот — считаются общедоступными в мире задолго до даты подачи заявок на их регистрацию.
Следует отметить, что к таким выводам независимо друг от друга пришли как судебный эксперт, так и эксперты Укрпатента, в своих заключениях подтвердившие несоответствие полезных моделей по спорным патентам Украины такому условию патентоспособности, как новизна.
И уже 02.07.2018 г. Хозяйственный суд г. Киев принял решение в деле № 910/4881/18, которым удовлетворил иск Компании к владельцу инновационных лекарственных средств и Министерству экономического развития и торговли Украины о признании патентов Украины № 120761, № 120762, № 120763 и № 120764 от 10.11.2017 г. недействительными и обязал Министерство опубликовать в официальном бюллетене «Промышленная собственность» соответствующую информацию.
Постановлением Верховного суда от 18 декабря 2018 г. это решение и постановление Киевского апелляционного хозсуда от 27.09.2018 г. были оставлены без изменений.
Во исполнение решений хозяйственных судов в деле № 910/4881/18 патенты Украины № 120761, № 120762, № 120763 и № 120764 от 10.11.2017 г. были признаны недействительными, соответствующие данные были опубликованы в бюллетене «Промышленная собственность» № 21 от 12 ноября 2018 г.
Следует подчеркнуть, что признание патента недействительным — это не его преждевременная кончина (если измерять его «жизнь» человеческими понятиями) — это по сути отмена факта его существования: все правоотношения, возникавшие в связи с ним, полностью «обнуляются». Иными словами, не было объекта правовой охраны — не было и нет прав на него — не может быть и фактов их нарушения.
Но наша история, достойная пера М. Булгакова, на этом не закончилась: патенты, признанные таковыми, которых не было, продолжают активно защищать монополию своего владельца и сейчас.
«Мы охраняем гений твой»3
В апреле этого года директору патентного ведомства одной небратской страны задали на форуме вопрос: «Почему вы перестали выдавать бумажные патенты, как это было раньше?».
— Потому что эта «бумажка» дорогостоящая в исполнении (вы можете по-прежнему ее получить, уплатив отдельный сбор), но фактически вам ничего не дает — суды и другие компетентные ведомства пользуются данными госреестра изобретений и полезных моделей, информация о статусе которых постоянно обновляется, — ответил он.
Такая же информация представлена на сайте Укрпатента, более того — там есть отдельная информационно-справочная система «Сведения о патентах Украины на изобретения (полезные модели), признанных недействительными, и патентах, действие которых прекращено».
Но так уж сложилось, что бумаге человек доверяет больше, чем интернету: попробуйте заставить судью N-ского районного суда X-кой области порыться в базах данных на предмет того, действует патент или нет, — оно ему надо?
В итоге уже несколько судов не только принимали в свое производство иски, основанные на несуществующих патентах, но и выносили определения о применении мер по их обеспечению — запрету «контрафактной» продукции конкурента.
Конечно, можно снова и снова обжаловать очередное «патентное» обеспечение, доказывая, что признанные недействительными патенты не самовосстановились, а их бумажная форма — это как портрет Дориана Грея — вечно молодой после смерти хозяина. Но у меня возникает вопрос: если в ХХI в. украинский суд, всецело доверяя «гербовой» бумаге, с легкостью закрывает вход на украинский фармрынок европейскому товаропроизводителю, презюмируя «контрафактность» его лекарственных средств, — может быть, тогда Компании, в свою очередь, следует обращаться за эффективной защитой своих прав не в суд, а в… типографию? Где на такой же «гербовой» бумаге «именем Украины» быстро и качественно напечатают единственно правильное в такой ситуации решение.
К чести экс-владельца «мертворожденных» патентов, следует отметить, что он пробовал добиться и их реальной реинкарнации: два его бенефициара пытались обжаловать решения хозяйственных судов в деле № 910/4881/18.
Одними из оснований для пересмотра решения Хозяйственного суда г. Киев от 2 июля 2018 г. были предложены заключения «комплексной» экспертизы патентов, в которых кандидат химических наук сделал выводы не только о новизне водных растворов для инъекций, но и о… новизне химических веществ, почему-то заявленных в патентах под общепринятыми названиями «морфин», «диазепам», «промедол» и «фентанил».
Так, молекула «запатентованного» промедола отличалась от структурной формулы вещества, приведенного на с. 562 Х Государственной Фармакопеи, отсутствием обозначения «СН3» как стандартного заместителя атома водорода в бензольном кольце (указана открытая связь). По мнению эксперта, «это свидетельствует, что они отличаются: Фармакопея содержит указания на метильные группы, в то время как формула полезной модели указывает на кольцевую структуру» (с).
Кроме того, эксперты обратили внимание и на разницу названий «промедол» и «тримеперидин (trimeperidine)», что, безусловно, свидетельствует о мировой новизне объекта полезной модели по патенту № 120763.
К сожалению, суды не дали должной оценки этим новациям ввиду отсутствия у заявителей апелляционных и кассационных жалоб права требовать пересмотра решений хозяйственных судов в деле № 910/4881/18, поскольку они не касались прав и обязанностей заявителей.
11 июля 2019 г. Верховный суд в составе коллегии судей Кассационного хозяйственного суда оставил кассационные жалобы в деле № 910/4881/18 без удовлетворения, а решения хозсудов — в силе. Постановления Верховного суда окончательны и обжалованию не подлежат.
Однако отечественный арсенал средств защиты прав интеллектуальной собственности неисчерпаем — ждем теперь заявлений о пересмотре решений в деле № 910/4881/18 по вновь открывшимся обстоятельствам.
Ну и «бумажные» патенты никто ни у кого не отнимал!
Спалили рукопись мою,
Но лишь сильней она в бою!
Дым от страниц сплотится в яд!
Рукописи не горят!
Живёт идеей мой сюжет,
В нём для безумцев места нет!
Вас буквы в камень превратят!
Рукописи не горят! (Спектакль Джо).
Ирина Кириченко,
адвокат, патентный поверенный Украины
1IUPAC (ИЮПАК) — Международный союз теоретической и прикладной химии.
2Агата Кристи, «Опуим для никого», 1994 г. (reproduktor.net/agata-kristi/opium-dlya-nikogo)
3Песня «Рукописи не горят», Спектакль Джо, 2018 г.
Интересная информация для Вас:
 Возраст, избыточная масса тела, наследственность, беременность, сидячая работа в офисе, гиподинамия… Повышенному риску развития венозной недостаточности подвергается практически каждая женщина. Вывод — необходимы профилактика и своевременное лечение. В противном случае, варикоз неумолимо прогрессирует, увеличивается выраженность субъективных симптомов. Так, у каждого второго пациента развивается тромбофлебит, чреватый тромбоэмболическими осложнениями (Tsai S. et al., 2005). Фармацевтам вполне под силу сформировать у пациентов осознанное отношение к своему здоровью: шире рекомендовать профилактику и лечение хронической венозной недостаточности.
Возраст, избыточная масса тела, наследственность, беременность, сидячая работа в офисе, гиподинамия… Повышенному риску развития венозной недостаточности подвергается практически каждая женщина. Вывод — необходимы профилактика и своевременное лечение. В противном случае, варикоз неумолимо прогрессирует, увеличивается выраженность субъективных симптомов. Так, у каждого второго пациента развивается тромбофлебит, чреватый тромбоэмболическими осложнениями (Tsai S. et al., 2005). Фармацевтам вполне под силу сформировать у пациентов осознанное отношение к своему здоровью: шире рекомендовать профилактику и лечение хронической венозной недостаточности. 16 липня цього року до приміщення ДЕЦ у супроводі співробітників СБУ прийшла слідча ДБР, яка повідомила пані Т. Думенко про підозру у вчиненні злочину, передбаченого ч. 2 ст. 367 Кримінального кодексу України (службова недбалість, що спричинила тяжкі наслідки). Суть підозри зведена до того, що ДЕЦ протягом тривалого часу орендував приміщення для розміщення працівників. У подальшому орендар почав вимагати різкого підвищення орендної плати із передплатою, що було неможливо для ДЕЦ. У зв’язку із цим Т. Думенко було прийнято рішення про розірвання даних договірних відносин. У подальшому на підставі документів, що мають ознаки підробки, орендар стягнув з ДЕЦ вартість оренди, штрафні санкції. За версією ДБР та Генеральної прокуратури України (ГПУ), Т. Думенко вчинила службову недбалість, яка полягала в тому, що з ДЕЦ стягнуто за рішеннями судів пеню, судовий збір, виконавчий збір.
16 липня цього року до приміщення ДЕЦ у супроводі співробітників СБУ прийшла слідча ДБР, яка повідомила пані Т. Думенко про підозру у вчиненні злочину, передбаченого ч. 2 ст. 367 Кримінального кодексу України (службова недбалість, що спричинила тяжкі наслідки). Суть підозри зведена до того, що ДЕЦ протягом тривалого часу орендував приміщення для розміщення працівників. У подальшому орендар почав вимагати різкого підвищення орендної плати із передплатою, що було неможливо для ДЕЦ. У зв’язку із цим Т. Думенко було прийнято рішення про розірвання даних договірних відносин. У подальшому на підставі документів, що мають ознаки підробки, орендар стягнув з ДЕЦ вартість оренди, штрафні санкції. За версією ДБР та Генеральної прокуратури України (ГПУ), Т. Думенко вчинила службову недбалість, яка полягала в тому, що з ДЕЦ стягнуто за рішеннями судів пеню, судовий збір, виконавчий збір.
 Эксперты единодушны в том, что светотерапия является одним из наиболее эффективных методов для профилактики орального мукозита — болезненных язв во рту, которые возникают в результате лечения онкологических заболеваний. Светотерапия вошла в руководящие принципы Многонациональной ассоциации поддерживающей терапии при раке (Multinational Association of Supportive Care in Cancer — MASCC) и Международного общества оральной онкологии (International Society of Oral Oncology — ISOO).
Эксперты единодушны в том, что светотерапия является одним из наиболее эффективных методов для профилактики орального мукозита — болезненных язв во рту, которые возникают в результате лечения онкологических заболеваний. Светотерапия вошла в руководящие принципы Многонациональной ассоциации поддерживающей терапии при раке (Multinational Association of Supportive Care in Cancer — MASCC) и Международного общества оральной онкологии (International Society of Oral Oncology — ISOO). Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена.
Немногие из тех, кто хотел бы стать всесильным обладателем такого необходимого в конкуренции «гаджета», знают, что сегодня для этого не надо ни обогащать природный уран, ни угощать конкурента «новичком» — достаточно наполнить «чемоданчик» правильными «бумажками» — патентами и свидетельствами на товарные знаки: все — единственная законная монополия на целую нишу товаров и/или услуг вам обеспечена.

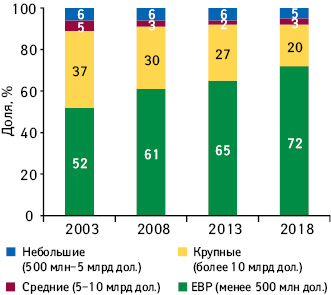
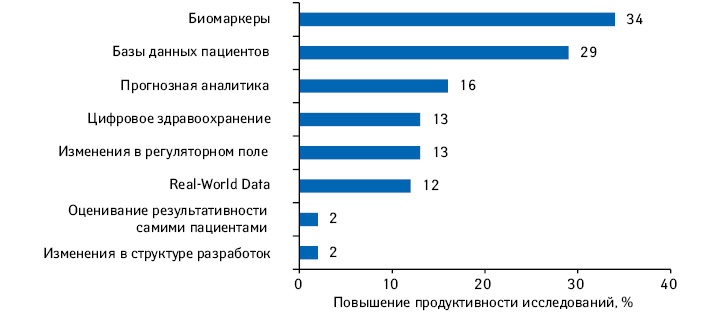
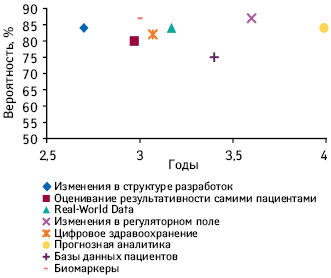
 2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.
2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.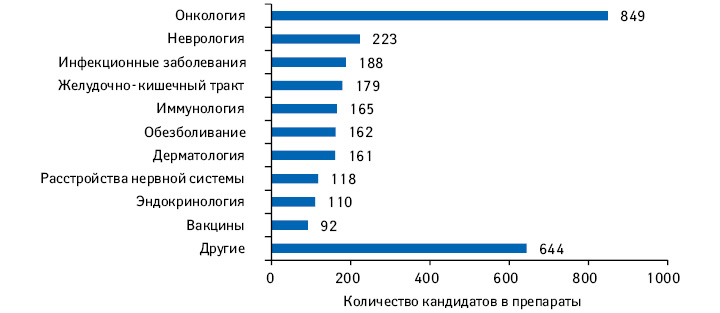
 На урядовому порталі оприлюднено
На урядовому порталі оприлюднено 18 июля «IntelliQuit» объявил о лонче первой в мире платформы для мониторинга потребления никотина, основанной на облачных технологиях. Мобильное приложение IntelliQuit Mobile App (доступное в Apple App Store по цене 0,99 дол. США) является первой технологией для смартфона, биохимически измеряющей потребление никотина из разных источников. Независимо от того, поступает ли никотин из обычных или электронных сигарет, устройств для вейпинга, сигар, трубок, электронных систем высвобождения никотина, продуктов и/или продуктов для никотинзаместительной терапии, приложение IntelliQuit определяет поступление никотина из любых источников.
18 июля «IntelliQuit» объявил о лонче первой в мире платформы для мониторинга потребления никотина, основанной на облачных технологиях. Мобильное приложение IntelliQuit Mobile App (доступное в Apple App Store по цене 0,99 дол. США) является первой технологией для смартфона, биохимически измеряющей потребление никотина из разных источников. Независимо от того, поступает ли никотин из обычных или электронных сигарет, устройств для вейпинга, сигар, трубок, электронных систем высвобождения никотина, продуктов и/или продуктов для никотинзаместительной терапии, приложение IntelliQuit определяет поступление никотина из любых источников. 18 июля в журнале «Lancet» опубликованы результаты двух обзоров, посвященных достижениям стран в борьбе против артериальной гипертензии. В первом из них рассматривали ситуацию в 12 странах с высоким, во втором — с низким и средним. Распространенность артериальной гипертензии была наименьшей в Канаде, Южной Корее, Австралии и Великобритании, а наибольшей — в Финляндии. Улучшение информированности и контроля происходило следующим образом: в 1980-х и начале 1990-х годах уровень охвата лечением составлял в среднем 40% и контроля — менее 25% в большинстве стран и поло-возрастных групп. В последующем эти показатели улучшились во всех 12 странах, особенно — в Южной Корее и Германии. По данным самых свежих отчетов, Канада, Германия, Южная Корея и США достигли лучших показателей осведомленности, охвата лечением и контроля, тогда как Финляндия, Ирландия, Япония и Испания — наиболее низких. Даже в наиболее успешных странах охват лечением не превышал 80%, а контроля — 70%.
18 июля в журнале «Lancet» опубликованы результаты двух обзоров, посвященных достижениям стран в борьбе против артериальной гипертензии. В первом из них рассматривали ситуацию в 12 странах с высоким, во втором — с низким и средним. Распространенность артериальной гипертензии была наименьшей в Канаде, Южной Корее, Австралии и Великобритании, а наибольшей — в Финляндии. Улучшение информированности и контроля происходило следующим образом: в 1980-х и начале 1990-х годах уровень охвата лечением составлял в среднем 40% и контроля — менее 25% в большинстве стран и поло-возрастных групп. В последующем эти показатели улучшились во всех 12 странах, особенно — в Южной Корее и Германии. По данным самых свежих отчетов, Канада, Германия, Южная Корея и США достигли лучших показателей осведомленности, охвата лечением и контроля, тогда как Финляндия, Ирландия, Япония и Испания — наиболее низких. Даже в наиболее успешных странах охват лечением не превышал 80%, а контроля — 70%. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 18 июля напомнило, что с вождением транспортных средств несовместим прием ряда лекарств, в число которых входят:
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) 18 июля напомнило, что с вождением транспортных средств несовместим прием ряда лекарств, в число которых входят: Об’єднання організацій роботодавців медичної та мікробіологічної промисловості України (ООРММП України) повідомляє про існування правової колізії, яка полягає в тому, що сьогодні на ввезення активних фармацевтичних інгредієнтів (АФІ) гепарин та хондроїтин розповсюджуються норми законодавства, як у сфері лікарських засобів, так і в галузі харчових продуктів, оскільки ці два АФІ потрапили до Переліку товарів, які підлягають державному контролю за дотриманням законодавства про харчові продукти, корми, побічні продукти тваринного походження, здоров’я та благополуччя тварин (крім ввезення з метою транзиту), затвердженого постановою КМУ від 24.10.2018 р. № 960. У зв’язку з цим ввезення даних АФІ потребує проведення державної санітарно-епідеміологічної експертизи, хоча згідно із законодавством про лікарські засоби вони підпадають під визначення «лікарські засоби» і не потребують проходження даної експертизи. Тому ООРММП України звернулося до міністра юстиції України з проханням надати роз’яснення щодо правомірності застосування до лікарських засобів (АФІ) норм, які застосовуються для харчових продуктів, кормів, побічних продуктів тваринного походження, здоров’я та благополуччя тварин. Пропонуємо увазі читачів повний текст листа.
Об’єднання організацій роботодавців медичної та мікробіологічної промисловості України (ООРММП України) повідомляє про існування правової колізії, яка полягає в тому, що сьогодні на ввезення активних фармацевтичних інгредієнтів (АФІ) гепарин та хондроїтин розповсюджуються норми законодавства, як у сфері лікарських засобів, так і в галузі харчових продуктів, оскільки ці два АФІ потрапили до Переліку товарів, які підлягають державному контролю за дотриманням законодавства про харчові продукти, корми, побічні продукти тваринного походження, здоров’я та благополуччя тварин (крім ввезення з метою транзиту), затвердженого постановою КМУ від 24.10.2018 р. № 960. У зв’язку з цим ввезення даних АФІ потребує проведення державної санітарно-епідеміологічної експертизи, хоча згідно із законодавством про лікарські засоби вони підпадають під визначення «лікарські засоби» і не потребують проходження даної експертизи. Тому ООРММП України звернулося до міністра юстиції України з проханням надати роз’яснення щодо правомірності застосування до лікарських засобів (АФІ) норм, які застосовуються для харчових продуктів, кормів, побічних продуктів тваринного походження, здоров’я та благополуччя тварин. Пропонуємо увазі читачів повний текст листа. Згідно з даними Центру громадського здоров’я (ЦГЗ) протягом 29-го тижня (
Згідно з даними Центру громадського здоров’я (ЦГЗ) протягом 29-го тижня ( Міністерство охорони здоров’я України (МОЗ) повідомляє про закупівлю додаткових доз вакцин проти кору, паротиту та краснухи (КПК). Відповідну постанову прийняв Кабінет Міністрів України (КМУ). Закупівля вакцини буде здійснена в розмірі понад 2 млн доз.
Міністерство охорони здоров’я України (МОЗ) повідомляє про закупівлю додаткових доз вакцин проти кору, паротиту та краснухи (КПК). Відповідну постанову прийняв Кабінет Міністрів України (КМУ). Закупівля вакцини буде здійснена в розмірі понад 2 млн доз. Аптеки «Walmart» и «Sam’s Club» сообщают о расширении своей инициативы по внедрению «говорящих» этикеток ScripTalk в аптеках «Walmart» и «Sam’s Club» по всей территории США. Предназначены эти устройства для слепых и слабовидящих пациентов. Так, с 2012 г. «Walmart» и «Sam’s Club» оснастили почти 1200 своих аптек оборудованием для предоставления звуковых этикеток ScripTalk по запросу пациента. Только за последние 3 года было оборудовано более 750 аптек.
Аптеки «Walmart» и «Sam’s Club» сообщают о расширении своей инициативы по внедрению «говорящих» этикеток ScripTalk в аптеках «Walmart» и «Sam’s Club» по всей территории США. Предназначены эти устройства для слепых и слабовидящих пациентов. Так, с 2012 г. «Walmart» и «Sam’s Club» оснастили почти 1200 своих аптек оборудованием для предоставления звуковых этикеток ScripTalk по запросу пациента. Только за последние 3 года было оборудовано более 750 аптек. Міжнародна фармацевтична компанія Merck & Co. (за межами США і Канади відома як MSD) разом з групою гравців, що координуються некомерційною організацією з надання гуманітарної допомоги Direct Relief, перевіряє працездатність ідеї щодо використання безпілотників для доставки лікарських засобів.
Міжнародна фармацевтична компанія Merck & Co. (за межами США і Канади відома як MSD) разом з групою гравців, що координуються некомерційною організацією з надання гуманітарної допомоги Direct Relief, перевіряє працездатність ідеї щодо використання безпілотників для доставки лікарських засобів. Міністерство охорони здоров’я України повідомляє, що з вересня 2019 р. фінансування інноваційних наукових проектів у медицині стане цільовим.
Міністерство охорони здоров’я України повідомляє, що з вересня 2019 р. фінансування інноваційних наукових проектів у медицині стане цільовим.